Амфотерность соединений
Амфотерные оксиды и основания проявляют кислотно-основную двойственность: не взаимодействуют с водой, но образуют соли как с сильными кислотами, так и со щелочами. Причем если в реакциях сплавления со щелочными оксидами, щелочами и карбонатами образуются средние соли, то в избытке растворов щелочей получается смесь солей: в основном гидроксокомплексы, но также и средние соли (мета- и орто-).
Пример 1:
а) 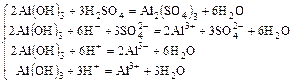
b) 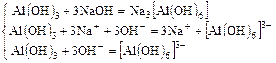
c) 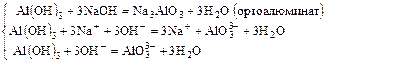
или 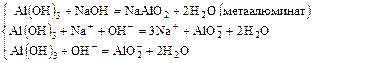
Пример 2:
а) 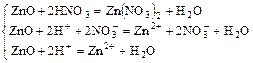
b) 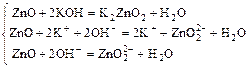
или 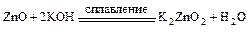 (в ионном виде писать не корректно).
(в ионном виде писать не корректно).
Гидролиз солей
Гидролиз солей - взаимодействие ионов соли с молекулами воды, которое приводит к образованию слабого электролита и может изменить рН среды.
«Гидролиз» означает «разложение водой» и химизм этого процесса понятен при записи его в ионном виде.
Степень гидролиза (h) – количественная мера гидролиза солей:
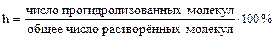 .
.
h зависит от:
а)температуры (чем выше температура, тем h больше);
б)концентрации (при разбавлении раствора h возрастает);
в)от природы соли (чем слабее электролит, который соответствует гидролизующемуся иону, тем больше h). Важной количественной характеристикой гидролиза является константа гидролиза (Кгидр.)
Рассмотрим примеры гидролиза солей различного типа.
I. Соль образована слабым основанием и сильной кислотой:
NH4Cl + H2O Û NH4OH + HC1;
NH4+ + Сl- + Н2О Û NH4OH + Н+ + Cl-;
NH4+ + Н2О Û NH4OH + H+ ; гидролиз идет по катиону, рН < 7.
Константа гидролиза 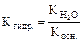 .
.
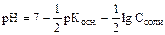 .
.
2. Соль образована сильным основанием и слабой кислотой:
KCN + Н2О Û КОН + HCN
К+ + CN- + Н2OÛ К++ ОН- + HCN
CN- + Н2О Û ++ ОН- + HCN; гидролиз идет по аниону, рН > 7.
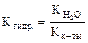 ;
; 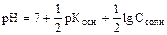
3.Соль образована слабым основанием и слабой кислотой:
NH4CN + H20 Û NH4OH + HCN;
NH4+ + CN- + H2O Û NH4OH + HCN гидролиз идет по катиону и аниону, рН » 7.
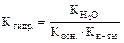 ;
; 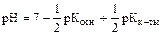 .
.
Если валентность иона, по которому идет гидролиз, больше I, то возможен ступенчатый процесс, причем по первой ступени он идет лучше всего. Получаются основные или кислые соли.
Для подавления гидролиза, т.е. для снижения величины h, при приготовлении растворов солей туда добавляют немного или соответствующей сильной кислоты (например НС1 – как для случая 1), или сильного основания (например КОН – пример 2, гидролиз соли КСN). По принципу Ле-Шателье равновесие в реакции гидролиза смещается влево, h уменьшается.
В химической лаборатории растворы солей (во избежание гидролиза) лучше хранить в виде концентрированных растворов и в прохладном месте.
Вопросы для закрепления материала:
1.Какие из приведенных веществ являются амфолитами – ZnO, FeO, CrO3, MnO, Al(OH)3 ? Напишите для них молекулярные и ионные реакции взаимодействия с соляной кислотой и едким натром.
2.Какая из солей подвергается гидролизу – KCI или КСН3СОО? Напишите молекулярное и ионное уравнения.
Дата добавления: 2017-10-04; просмотров: 1757;











