Классификация растворов
1. По агрегатному состоянию:
а) Газообразные (воздух, воздушные смеси) . В растворах газов, как и в индивидуальных веществах, находящихся в газообразном состоянии, наблюдается слабое взаимодействие между молекулами смешиваемых веществ. Для газового раствора характерно химическое движение молекул и отсутствие определенной геометрической структуры. Они находятся в виде химической смеси, каждому компоненту которой присущи индивидуальные физические и химические свойства. В качестве примера такой смеси можно привести воздух, состоящий из растворенных друг в друге азота, кислорода, углекислого газа, инертных и др. газов, паров воды и некоторых твердых микрочастиц (которые называют пылью).
б) Твердые (сплавы, таблетки, пища). Они представляют собой однородные крисьталлы, образующиеся, как правило, из металлов. При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же рнастворимы друг в друге лишь до определенной концентрации. Для получения твердого раствора проводят охлаждение расплава, что сопровождается, как правило, выпадением кристаллов.
в) Жидкие (плазма крови, лимфа, речная и морская вода, микстуры). Они обладают внутренней структурой, которая при больших разбалениях близка к структуре растворителя, а в концентрированных растворах – растворенного вещества. Этот тип растворов наиболее распространен.
2. По физическим свойствам (например электропроводность):
а) неэлектролиты (раствор глюкозы);
б) электролиты (физиологический раствор).
3. По размеру частиц:
a) истинные растворы (растворенные вещества находятся в растворе в виде молекул или ионов);
признаки: (1) прозрачны;
(2) устойчивы при хранении;
(3) диаметр частиц < 1 ммк.
б) коллоидные растворы (растворенные вещества в виде сложных агрегатов);
признаки: (1) при прохождении света через раствор специфично рассеивают его, образуя конус Тиндаля;
(2) при хранении разрушаются;
(3) диаметр частиц лежит в интервале 1 - 100 ммк
в) дисперсные системы (взвеси)
существуют в виде эмульсий или суспензий;
признаки: (1) непрозрачны;
(2) неустойчивы;
(3) диаметр частиц > 100 ммк
4. По количеству растворенных частиц:
a) насыщенные (устойчивы - имеет место равновесие между раствором и твердым веществом); ∆G = 0.
б)ненасыщенные; ∆G < 0.
в)пересыщенные. ∆G > 0; система неустойчива, при встряхивании из них образуются насыщенные растворы и выделяется избыток растворённого вещества.
Растворимость газов
Этот процесс можно рассматривать:
1) либо как механический процесс (действие сил Ван-дер-Ваальса) – например при растворении в воде Н2 , О2 , N 2 , инертных газов;
2)либо как химическое взаимодействие
(NH3 + H2O = NH4OH ; Cl2 + H2O = HCl + HClO).
Растворимость газов зависит от нескольких факторов:
1. От давления по закону Генри – масса газа, растворяющегося в данном объёме жидкости при постоянной температуре, прямо пропорциональна его парциальному давлению:
mгаза = k × P,
где m – масса газа в растворе;
k – константа пропорциональности;
Р – парциальное давление.
2. От температуры – чем выше температура, тем хуже растворяется газ.
3. От наличия в растворе других веществ по закону И.М. Сеченова (был выведен при подсчёте кислородной ёмкости крови) – на растворимость газов в жидкости влияют другие вещества:
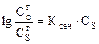 ,
,
где 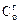 - растворимость газа в чистом растворителе;
- растворимость газа в чистом растворителе;
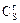 - растворимость газа в растворе соли;
- растворимость газа в растворе соли;
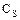 - концентрация соли в растворе;
- концентрация соли в растворе;
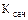 - константа Сеченова, положительная величина.
- константа Сеченова, положительная величина.
Анализ формулы показывает, что всегда 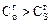 .
.
Растворимость жидких и твёрдых веществ
1. Как правило не зависит от давления, потому что при смешивании жидкостей объем меняется незначительно и может измениться только при давлении в несколько тысяч атмосфер;
2. Как правило это эндотермический процесс: при повышении температуры растворимость возрастает, так как энергия затрачивается на разрушение кристаллической решетки и равномерное распределение молекул (ионов) по всему объему раствора.
3. Если же при растворении выделяется теплота, то следовательно в растворе образуются сольватные частицы (если растворитель – вода, то чакстицы называют гидратными) и процесс будет экзотермическим.
Дата добавления: 2017-10-04; просмотров: 7183;











