Химическое равновесие
Химическое равновесие - такое состояние системы реагирующих веществ, когда uпрямой реакции = uобратной реакции.
Равновесие бывает:
а) истинное – оно соответствует такому состоянию системы, когда малое внешнее воздействие незначительно смещает равновесие;
б) кажущееся – малое воздействие на систему сильно смещает равновесие.
Константа равновесия (К) - количественная оценка химического равновесия; находится как отношение констант скорости прямой и обратной реакции.
Например для реакции nA + mB Û pC + qD
uпрямой реакции = k1×[A]n×[B]m;
uобратной реакции.= k2×[C]p×[D]q;
Т.к. uпрямой реакции = uобратной реакции., то
k1×[A]n×[B]m = k2×[C]p×[D]q,
отсюда
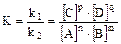 .
.
Величина К равновесия характеризует выход химической реакции:
1. K >>1 (∆G < 0) – выход реакции велик и она с большой полнотой протекает слева направо;
2. К = 1 (∆G = 0) – типично обратимая реакция, находится в состоянии равновесия;
3. K << 1 (∆G > 0) – прямая реакция не идёт, равновесие смещено в сторону обратной реакции.
Величина К зависит от природы веществ, температуры и не зависят от концентрации.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, производится какое-либо внешнее воздействие, то равновесие смещается в сторону реакции, уменьшающей это воздействие.
Возможные воздействия:
а) изменение концентрации за счет введения или выведения какого-либо вещества;
б) одновременное изменение всех концентраций за счет изменения давления или объема;
в) изменение температуры.
Пример:
Как сместится равновесие при изменении температуры для процесса:
2HI Û Н2 + I2 - Q.
Ответ: при нагревании извне равновесие сместится вправо, а при охлаждении – влево.
Вопросы для закрепления материала:
1.В каких единицах измеряется скорость химической реакции?
2.Написать выражение К равновесия для процесса N2 + 3H2 = 2NH3 . Куда сместится равновесие при увеличении давления?
УЧЕНИЕ О РАСТВОРАХ
Раствор - гомогенная равновесная система переменного состава, образованная из двух или более компонентов (ингредиентов).
Растворитель - среда, в которой растворенные вещества равномерно распределены в виде молекул или ионов.
Растворы часто занимают промежуточное состояние между механической смесью и химическим соединением.
Различия между раствором и химическим соединением:
1. состав раствора может варьироваться в очень широких пределах, а состав химического соединения неизменен;
2. из раствора можно выделять отдельные компоненты, не разрушая его однородности ( с химическим соединением это невозможно).
Различия между раствором и простой механической смесью:
1. часто при растворении образуются сольваты или гидраты:
CuSO4 + 4H2O = [Cu(H2O)4] SO4;
2. при растворении может измениться цвет раствора по сравнению с растворяемым веществом;
3. растворение часто сопровождается эндотермическим или экзотермическим эффектом.
Из этого следует, что растворение – это физико-химический процесс, в котором играют роль физические и химические явления. Согласно физической теории, растворы рассматривают как смеси, образующиеся в результате измельчения растворяемого вещества в среде растворителя без непосредственного химического взаимодействия с ним. При этом большая роль отводится такому физическому явлению, как диффузия. Благодаря диффузии молекулы, ионы удаляются с поверхности ратворяющегося векщества и равномерно распределяются по всему объему растворителя. Из-за этого, при отсутствии перемешивания, быстрота растворения зависит от скорости диффузии.
Дата добавления: 2017-10-04; просмотров: 1944;











