Диссоциация слабых электролитов. Константа диссоциации. Закон разбавления Оствальда
Сильные электролиты в растворе полностью диссоциируют на ионы. Для других электролитов диссоциация – процесс обратимый. Константа равновесия этого обратимого процесса называется константой диссоциации.
KА D K+ + А–
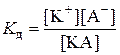 , ,
| (7.14) |
где Kд – константа диссоциации.
Константа диссоциации постоянна при определенной температуре и в отличие от степени диссоциации не зависит от концентрации. Значения констант диссоциации слабых электролитов приведены в таблице приложения 6.
Рассмотрим зависимость между степенью диссоциации и концентрацией электролита на примере слабого электролита - уксусной кислоты:
СН3СООН D СН3СОО– + Н+.
Принимая исходную концентрацию кислоты равной С, а степень диссоциации α, получаем, что концентрация части кислоты, которая диссоциирует на ионы, будет равна αС. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СН3СОО–, то их концентрации тоже будут равны по αС. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна (С – αС) = С(1 – α). Подставив значения равновесных концентраций ионов и кислоты в уравнение константы равновесия, получим:
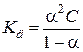 . .
| (7.15) |
Если степень диссоциации α << 1, то уравнение упрощается:
| Kд = α2С, | (7.16) |
откуда:
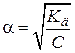 . .
| (7.17) |
Уравнения (7.15-7.17) называются законом разбавления Оствальда.
Слабые электролиты подчиняются закону разбавления Оствальда, согласно которому с увеличением концентрации степень диссоциации уменьшается, а константа диссоциации остается неизменной.
Дата добавления: 2017-11-21; просмотров: 2398;











