Диссоциация карбонатов и оксидов
Различные карбонаты и оксиды используются в качестве флюсующих добавок и для изготовления огнеупорных материалов.
Диссоциация карбонатов различных металлов происходит при их нагревании по обратимой реакции общего вида
МеСО3(Т) ↔ МеО(Т) + СО2(Г) + ΔН.
Реакция протекает в неоднородной системе.
Если диссоциация карбоната происходит без образования твердых растворов, то равновесная система состоит из двух твердых фаз (МеСО3 и МеО) одной газообразной (СО2), то есть количество фаз в системе Ф=3.
Система двухкомпонентна (три вещества в системе минус одно уравнение, связывающее их). Принимая в выражении правила фаз число независимых факторов n = 2, получим число степеней свободы системы С = 2-3+2=1, то есть система одновариантная.
Равновесное состояние такой системы обуславливается давлением СО2. Одновариантность системы означает, что каждой температуре должно соответствовать вполне определенное давление СО2
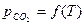 .
.
Вид данной функции можно получить из уравнения константы равновесия реакции
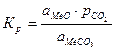 .
.
Активности чистых твердых веществ примерно равны единице, и практически 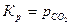 .
.
Величина 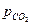 является количественной характеристикой полноты завершения обратимого превращения карбоната.
является количественной характеристикой полноты завершения обратимого превращения карбоната.
Количественное соотношение конденсированных веществ, образующих твердую фазу, не оказывает влияния на соотношение между температурой и равновесным давлением СО2. Если в равновесную систему вводят или из неё удаляют углекислый газ, то в первом случае развивается реакция образования карбоната, во втором - его диссоциации. В обоих случаях давление СО2 изменяется до величины, которая для данной температуры является равновесной.
Равновесное парциальное давление двуокиси углерода в реакции образования или диссоциации углекислого соединения называется упругостью диссоциации карбоната.
При отсутствии в системе твердых растворов она является функцией только температуры и эквивалентна константе равновесия.
При образовании твердых растворов переменой концентрации система будет состоять из одной твердой фазы (твердый раствор карбоната и оксида или твердый раствор карбоната и металла) и одной газообразной фазы (СО2), то есть Ф = 2. Согласно правилу фаз: С = 2-2+2=2, то есть система двухвариантная.
При образовании твердых растворов, кроме температурной зависимости, появляется дополнительная зависимость состояния равновесия от концентрации раствора 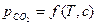 .
.
Зависимость 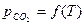 представлена на рисунке 7.
представлена на рисунке 7.






Рис. 7. Зависимость упругости диссоциации
карбоната 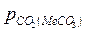 от температуры
от температуры
График 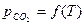 делит плоскость координат на две области: область образования карбоната, расположенную над графиком, и область диссоциации карбоната, расположенную под графиком.
делит плоскость координат на две области: область образования карбоната, расположенную над графиком, и область диссоциации карбоната, расположенную под графиком.
Если при температуре Та 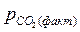 >
> 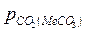 (точка а), то будет идти образование карбоната.
(точка а), то будет идти образование карбоната.
Если процесс идет при постоянном давлении 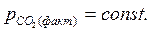 , например, при атмосферном, то этому давлению соответствует равновесная температура Тр. Если Т1 > Тр (точка 1), то
, например, при атмосферном, то этому давлению соответствует равновесная температура Тр. Если Т1 > Тр (точка 1), то 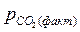 <
< 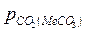 - идет диссоциация карбоната. Если Т2 < Тр (точка 2), то
- идет диссоциация карбоната. Если Т2 < Тр (точка 2), то 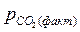 >
> 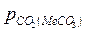 - идет образование карбоната.
- идет образование карбоната.
Процесс диссоциации оксидов аналогичен диссоциации карбонатов. Описывается процесс уравнением реакции в общем виде
2МеО (Т) ↔ 2Ме (Т) + О2(Г) + ΔН.
Если диссоциация оксида происходит без образования твердых растворов, то равновесная система состоит из двух твердых фаз (МеО и Ме) одной газообразной (О2), то есть количество фаз в системе Ф=3. Система двухкомпонентна. Число степеней свободы системы С=1 - система одновариантная.
Равновесное состояние такой системы обуславливается давлением О2. Одновариантность системы означает, что каждой температуре должно соответствовать вполне определенное давление кислорода
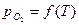 .
.
Вид данной функции можно получить из уравнения константы равновесия реакции
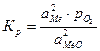 .
.
Принимая активности чистых твердых веществ равными единице, получаем 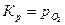 .
.
Величина 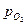 является количественной характеристикой полноты завершения обратимого превращения оксида. Если в равновесную систему вводят кислород, то идет окисление металла. Если из неё удаляют кислород, то происходит диссоциация оксида. В обоих случаях давление кислорода изменяется до величины, которая для данной температуры является равновесной.
является количественной характеристикой полноты завершения обратимого превращения оксида. Если в равновесную систему вводят кислород, то идет окисление металла. Если из неё удаляют кислород, то происходит диссоциация оксида. В обоих случаях давление кислорода изменяется до величины, которая для данной температуры является равновесной.
Равновесное парциальное давление кислорода в реакции образования или диссоциации оксида называется упругостью диссоциации оксида. При отсутствии в системе твердых растворов она является функцией только температуры и эквивалентна константе равновесия.
При образовании твердых растворов переменой концентрации система будет двухвариантная, то есть кроме температурной зависимости, появляется дополнительная зависимость состояния равновесия от концентрации раствора
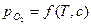 .
.
Пример. В качестве примера проведем анализ условий конденсатной диссоциации оксида алюминия Al2O3 при температурах выше температуры плавления алюминия (температура плавления алюминия 931,7К). Конденсатная диссоциация оксида алюминия (диссоциация с образованием металлического алюминия) описывается реакцией:
Al2O3 тв= 2Alж+ 1,5О2 г
Для этой реакции изменение изобарно-изотермического потенциала в интервале температур 923…1800К определяется соотношением:
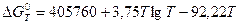 .
.
Согласно закону действующих масс константа равновесия реакции определяется следующим образом
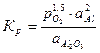 .
.
Так как активности конденсированных веществ обычно принимают равными единице, то
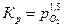 .
.
Энергия Гиббса и константа равновесия реакции связаны между собой соотношением 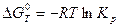 . Для рассматриваемой реакции:
. Для рассматриваемой реакции:
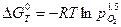 .
.
Подставив значение газовой постоянной и выполнив переход к десятичному логарифму, получим:
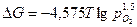 .
.
Отсюда получаем уравнение для расчета давления конденсатной диссоциации Al2O3 при температурах выше 931,7К. Оно имеет вид
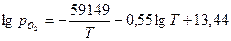 .
.
Величины давления конденсатной диссоциации оксида алюминия, вычисленные по полученному уравнению, для температур 932К и 1173К составляют 10-47 Па и 10-34 Па соответственно. Таким образом, с повышением температуры равновесное давление конденсатной диссоциации оксида алюминия повышается, но в реальных условиях оно не может быть реализовано. Следовательно, конденсатная диссоциация Al2O3 в реальных условиях невозможна.
Анализ условий диссоциации закиси железа FeO и оксида никеля NiO, выполненные аналогично диссоциации оксида алюминия, показал, что равновесное давление кислорода при 1300К для диссоциации этих оксидов составляет 10-9,4 Па. Согласно экспериментальным данным по исследованию состава газовой фазы при диссоциации NiO, конденсатная диссоциация возможна при температурах выше 1475К, при более низких температурах диссоциация NiO происходит конгруэнтно (в газовую фазу преимущественно переходит Ni). Незначительное развитие имеет реакция NiOтв.=Ni2+O2.
Таким образом, термодинамическая оценка процессов диссоциации соответствует экспериментальным данным. Их сопоставление позволяет сделать вывод, что в равновесных условиях диссоциация низших оксидов никеля и железа при температурах выше 1400К возможна по механизму газовой диссоциации. При более низких температурах удаление оксидов с поверхности стальных, никелевых, железо-никелевых и железо-никель-кобальтовых сплавов должно протекать по другим механизмам.
Дата добавления: 2017-05-02; просмотров: 2084;











