НЕКОТОРЫЕ ПОНЯТИЯ ЭНЕРГЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Термодинамическая система – любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей раздела. Объекты природы, не входящие в систему, называются средой.
Изолированная система – такая система, которая не обменивается со средой ни веществом, ни энергией.
Закрытая система – система, которая не обменивается со средой веществом, но может обмениваться энергией.
Открытая система – система, которая может обмениваться со средой как веществом, так и энергией.
Процесс – переход системы из одного состояния в другое, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.
Химические реакции бывают:
экзотермические – сопровождаются выделением тепла;
эндотермические – сопровождаются поглощением тепла.
Тепловой эффект – количество выделившегося или поглощённого тепла, если единственным видом работы является работа расширения.
Закон Гесса: тепловой эффект процесса зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути процесса, т.е. от числа и характера промежуточных стадий (при постоянном объеме или давлении).
Следствия:
1. Тепловой эффект реакции равен сумме теплот образования ( 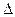 Нобр.) продуктов реакции за вычетом суммы теплот образования исходных веществ;
Нобр.) продуктов реакции за вычетом суммы теплот образования исходных веществ;
2. Тепловой эффект реакции равен сумме теплот сгорания ( 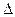 Нсгор.) исходных веществ за вычетом суммы теплот сгорания продуктов реакции.
Нсгор.) исходных веществ за вычетом суммы теплот сгорания продуктов реакции.
При этом:
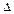 Нобр. (теплота образования, энтальпия образования) – тепловой эффект образования 1 моля вещества из простых веществ, устойчивых в стандартных условиях.
Нобр. (теплота образования, энтальпия образования) – тепловой эффект образования 1 моля вещества из простых веществ, устойчивых в стандартных условиях.
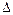 Нсгор. (теплота сгорания) – тепловой эффект сгорания 1 моля вещества до продуктов окисления.
Нсгор. (теплота сгорания) – тепловой эффект сгорания 1 моля вещества до продуктов окисления.
а)В случае экзотермических реакций 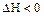 .
.
Пример: 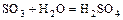
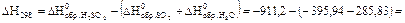
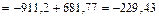 (кДж/моль).
(кДж/моль).
б)Для эндотермических реакций 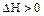 .
.
Пример: 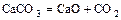
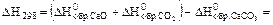
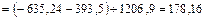 (кДж/моль).
(кДж/моль).
Энергетический эффект химического процесса возникает за счёт изменения в системе внутренней энергии U или энтальпии H.
Внутренняя энергия (U) складывается из энергий движения молекул, их взаимодействия; колебательных движений атомов; внутренней энергии ядер и их взаимодействия и т.д.
Пусть какая-то система за счёт поглощения теплоты Q переходит из состояния 1 в состояние 2. В общем случае эта теплота расходуется на изменение внутренней энергии системы ( 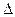 U) и на совершение работы против внешних сил (А):
U) и на совершение работы против внешних сил (А):
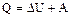 - закон сохранения энергии.
- закон сохранения энергии.
Работа против внешних сил (А) – в основном работа против внешнего давления.
При переходе из состояния 1 в состояние 2 при P = const 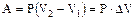 .
.
1. Изохорный процесс (V = const)
А = 0 и 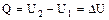 .
.
Т.е. выделение или поглощение теплоты QV связано с изменением внутренней энергии.
2. Изобарный процесс (Р = const)
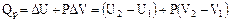
или
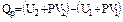 .
.
Введём обозначение 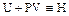 , тогда
, тогда 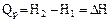 .
.
Энтальпия (Н) – энергия расширенной системы.
Т.к. большинство реакций протекает изобарно, то обычно энергетические эффекты реакций определяют по изменению величины энтальпии системы.
При экзотермических процессах теплота выделяется, следовательно, уменьшается энтальпия и внутренняя энергия, поэтому 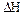 и
и 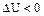 .
.
При эндотермических процессах теплота поглощается, следовательно, энтальпия и внутренняя энергия увеличивается, 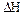 и
и 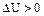 .
.
Т.о. энтальпия является мерой упорядоченности системы.
Энтальпийный фактор 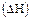 характеризует стремление системы к понижению потенциальной энергии.
характеризует стремление системы к понижению потенциальной энергии.
Энтропия (S) – количественная мера беспорядка.
При переходе системы из более упорядоченного состояния в менее упорядоченное энтропия возрастает ( 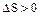 ).
).
При переходе системы из менее упорядоченного состояния в более упорядоченное энтропия уменьшается ( 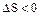 ).
).
Пример: рассмотрим превращения: кристалл ® жидкость ® газ.
В направлении ® упорядоченность структурных единиц падает и энтропия возрастает.
Для химических реакций увеличение числа газообразных молекул ведёт к возрастанию энтропии.
Пример 2: сравним табличные величины
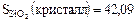 Дж/град×моль,
Дж/град×моль,
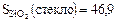 Дж/град×моль.
Дж/град×моль.
В кристаллах SiO2 структура более упорядоченная, чем в аморфном стекле, и поэтому S кристалла < S стекла.
Энтропийный фактор 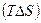 характеризует стремление системы к возрастанию энтропии.
характеризует стремление системы к возрастанию энтропии.
В химических процессах одновременно имеет место два явления, два противоположных фактора: энтропийный (стремление частиц разъединиться) и энтальпийный (стремление частиц объединиться в более сложные).
Энергия Гиббса или изобарно-изотермический потенциал (G)отражает этот суммарный процесс:
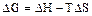 .
.
Характер изменения 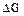 позволяет судить о термодинамической возможности процесса:
позволяет судить о термодинамической возможности процесса:
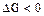 - процесс возможен;
- процесс возможен;
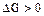 - самопроизвольное течение процесса невозможно;
- самопроизвольное течение процесса невозможно;
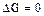 - имеет место химическое равновесие.
- имеет место химическое равновесие.
Величины изменения энергии Гиббса ( 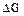 ) при реакции зависят от температуры, от природы и концентраций взятых и получающихся веществ.
) при реакции зависят от температуры, от природы и концентраций взятых и получающихся веществ.
Принято сравнивать величины 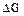 при стандартных условиях:
при стандартных условиях:
давление = 1 атм (для газов);
концентрация = 1 моль в 1000 г растворителя (для растворов);
температура 298 К.
Стандартное состояние – состояние вещества, находящегося в стандартных условиях.
Стандартные величины – термодинамические величины, характеризующие вещество в его стандартном состоянии.
Стандартные величины и их изменения обозначают с индексом «о»:
S0 – стандартная энтропия;
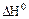 - стандартное изменение энтальпии;
- стандартное изменение энтальпии;
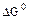 - стандартное изменение энергии Гиббса.
- стандартное изменение энергии Гиббса.
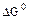 и
и 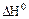 - табличные величины. Если элемент образует несколько веществ, то берётся наиболее устойчивое из них (при данной температуре).
- табличные величины. Если элемент образует несколько веществ, то берётся наиболее устойчивое из них (при данной температуре).
Для наиболее устойчивых простых веществ 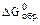 и
и 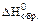 берут равными 0.
берут равными 0.
Закон Гесса для этих величин сохраняется:
1. Стандартное изменение энтальпии реакции ( 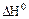 ) равно сумме стандартных энтальпий продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
) равно сумме стандартных энтальпий продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
2. Стандартное изменение энергии Гиббса реакции ( 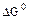 ) равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ.
) равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ.
Классическую термодинамику следует очень осторожно применять для анализа процессов жизни:
1. Она изучает изолированные и закрытые системы, а в живой природе таких систем нет.
2. Она не изучает механизмов никаких реакций, в том числе биохимических.
3. Т. к. состояние живых организмов определяется как неравновесное стационарное, то для их изучения необходима термодинамика необратимых процессов, которая в настоящее время интенсивно развивается.
Вопросы для закрепления материала:
1.Какое значение имеет К равновесия при 298 К, если энергия Гиббса = 0?
2.Почему при приближении абсолютной температуры к 0 энтропии веществ стремятся к 0?
Дата добавления: 2017-10-04; просмотров: 1504;











