ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Оксилительно-восстановительные реакции(ОВР) – реакции, идущие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – процесс отдачи электронов; степень окисления при этом возрастает.
Восстановление – процесс присоединения электронов; степень окисления при этом уменьшается.
Окислители – вещества, которые восстанавливаются в ОВР. Типичные окислители: O2, галогены, HNO3, нитраты, H2SO4 конц, HClOx, их соли, KMnO4, K2Cr2O7, … (большинство соединений, в которых элемент проявляет максимальную степень окисления).
Восстановители – вещества, которые окисляются в ОВР. Типичные восстановители: металлы, С, СО, H2S, сульфиды, NH3, PH3, галогеноводороды, MnSO4, CrCl3, … (соединения с элементами, проявляющими низшую степень окисления).
Redox-амфолиты – соединения с окислительно-восстановительной двойственностью:
1. Соединения, содержащие элементы с промежуточной степенью окисления; в зависимости от второго участвующего в реакции вещества (с ярко выраженной природой окислителя или восстановителя) они по-разному ведут себя в ОВР:
а) неметаллы и их соединения, например:
H2S (у S-2 минимальная степень окисления) - восстановительные свойства;
S0; S+4 (SO2, H2SO3, сульфиты) – в ОВР redox-амфотерны
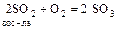 ,
, 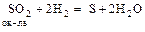 .
.
H2SO4 конц (у S+6 максимальная степень окисления) - окислительные свойства.
б) Соединения некоторых d – металлов
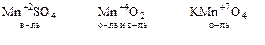
2. Водород пероксид H2O2
окислитель: 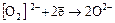 ,
,
восстановитель: 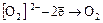 .
.
Дата добавления: 2017-10-04; просмотров: 1579;











