Химические свойства
- Диссоциация: в водном растворе растворимые соли распадаются на ионы
а) 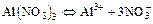 ;
;
б) 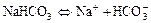 ;
;
в) 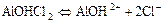 ;
;
г) 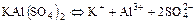 ;
;
д) 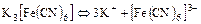
- металл + соль = менее активный металл + новая соль
(см. ряд напряжений)
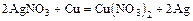
(для практических опытов нельзя использовать щелочные и щелочно-земельные металлы, т.к. они в обычных условиях реагируют прежде всего с водой)
- соль + основание = новая соль + более слабое основание
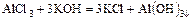
- соль + кислота = новая соль + более слабая кислота
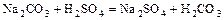
- соль + соль = 2 новые соли (одна из которых должна быть нерастворимой)
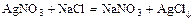
- термическое разложение некоторых солей
а) реакции без изменения степени окисления
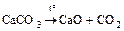 ;
;
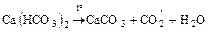 ;
;
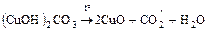 .
.
б) окислительно-восстановительный процесс
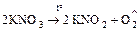 ;
;
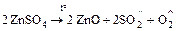 .
.
- некоторые соли с водой образуют кристаллогидраты
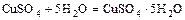
бесцв. голубые кристаллы
- Многие соли при растворении подвергаются гидролизу:
а) по катиону
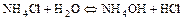
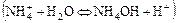
б) по аниону
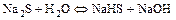
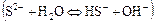 .
.
Получение
- кислота + основание = соль +
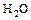
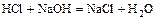 .
.
- кислота + о. оксид = соль +
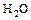
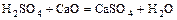 .
.
- к. оксид + основание = соль +
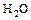
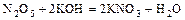 .
.
- к. оксид + о. оксид = соль
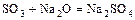 .
.
- кислота + соль = более слабая кислота + новая соль
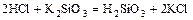 .
.
- соль + соль = две новые соли
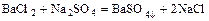 .
.
- основание + соль = более слабое основание + новая соль
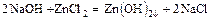 .
.
- металл + соль = менее активный металл + новая соль
Fe + СиС12 = FeС12 + Си (см. ряд напряжений)
- металл + кислота = соль + водород (кроме
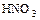 ,
, 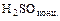 )
)
Mg + 2 НС1 = MgС12 + Н2 (см. ряд напряжений)
- металл + неметалл = соль (бескислородной кислоты)
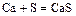 ;
;
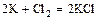 .
.
- термическое разложение некоторых солей
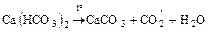 ,
,
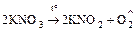 .
.
- амфотерный металл + щёлочь = неустойчивая соль +
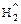
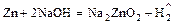 .
.
- сера или галоген + щёлочь = 2 новых соли + вода
(реакция диспропорционирования)
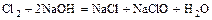 ,
,
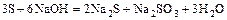 .
.
Номенклатурные правила для кислот и кислотных остатков
1. Если кислота бескислородная, то в её названии ставят окончание «водородная», а в кислотном остатке суффикс «ид».
2. При названии кислородных кислот этого окончания нет, а в соответствующем кислотном остатке пишут в конце букву «т».
3. Если элемент образует несколько кислородных кислот, проявляя различные степени окисления, то:
а) при максимальной степени окисления элемента в названии кислоты используют окончание «- ная» или «- овая», а в названии кислотного остатка – суффикс «ат»;
б) при минимальной степени окисления элемента кислоту называют с окончанием «- истая», а кислотный остаток называют с суффиксом «ит».
4. Если один и тот же оксид образует несколько разных кислот, которые отличаются разным содержанием воды, то в названиях кислот и солей используют приставки:
а) мета – минимальное содержание воды;
б) пиро – промежуточное содержание воды;
в) орто – максимальное содержание воды.
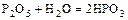 - метафосфорная
- метафосфорная
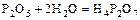 - пирофосфорная
- пирофосфорная
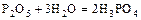 - ортофосфорная
- ортофосфорная
5. Если элемент образует много кислородных кислот, проявляя различные степени окисления, то используют дополнительные суффиксы и приставки:
а) при названии кислот по мере понижения степени окисления элемента суффиксы меняются в следующем порядке:
«- овая», «- оватая», «- истая», «- оватистая».
б) приставка «гипо» означает «наименьшая» (применительно к степени окисления), а приставка «пер» - наибольшая.
Таблица 3
Названия наиболее важных кислот и кислотных остатков
(в скобках указаны исторические названия)
| оксид | Кислота | Кислотный остаток |
| ¾ | HF – фтороводородная (плавиковая) | F- – фторид |
| ¾ | HCl – хлороводородная (соляная) | Cl- - хлорид |
| ¾ | H2S – сероводородная | S2- - сульфид |
| ¾ | HCN – циановодородная | CN- - цианид |
| ¾ | HCNS – тиоциановая (родановая) | CNS- - тиоцианат (роданид) |
| CO2 | H2CO3 – угольная | CO32- - карбонат |
| SiO2 | H2SiO3 – (мета)кремневая | SiO32- - (мета)силикат |
| H4SiO4 – ортокремневая | SiO44- - ортосиликат | |
| N2O3 | HNO2 – азотистая | NO2- - нитрит |
| N2O5 | HNO3 – азотная | NO3- - нитрат |
| P2O3 | H3PO3 – фосфористая | PO33- - фосфит |
| P2O5 | HPO3 – метафосфорная | PO3- - метафосфат |
| H4P2O7 – пирофосфорная | P2O74- - пирофосфат | |
| H3PO4 – (орто)фосфорная | PO43- - (орто)фосфат | |
| SO2 | H2SO3 – сернистая | SO32- - сульфит |
| SO3 | H2SO4 – серная | SO42- - сульфат |
| CrO3 | H2CrO4 – хромовая | CrO42- - хромат |
| H2Cr2O7 – двухромовая | Cr2O72- дихромат | |
| Mn2O7 | HMnO4 – марганцевая | MnO4- - перманганат |
| Cl2O | HClO – хлорноватистая (гипохлористая) | ClO- - гипохлорит |
| (Cl2O3) | HClO2 – хлористая | ClO2- - хлорит |
| (Cl2O5) | HClO3 – хлорноватая | ClO3- - хлорат |
| Cl2O7 | HClO4 – хлорная | ClO4- - перхлорат |
Вопросы для закрепления материала:
1.Какие гидроксиды соответствуют оксидам MnO2, SO3, BaO? Напишите их формулы и назовите. Какой гидроксид амфотерен?
2.Чем можно осушить аммиак – а)серной кислотой? б)хлористым кальцием? в)ангидридом фосфорной кислоты?
Дата добавления: 2017-10-04; просмотров: 1279;











