Строение комплексных соединений
1. В молекулах любого комплексного соединения один из атомов или ионов занимает пространственно центральное место и называется «центральный ион» или «ион-комплексообразователь».
Чаще всего это d – элементы (Ag+, Hg2+, Cr3+, Mn4+, …).
Реже р – элементы (В3+, Sn4+, As5+, Te6+, J7+, …).
Для s – элементов комплексообразующая способность мало характерна и подобные соединения существуют в основном в растворе.
Из отрицательно заряженных элементов - комплексообразователей следует отметить прежде всего N-3, S-2, J-.
2. Вокруг центрального иона в некоторой близости расположено определённое число ионов с противоположным зарядом или нейтральных молекул. Эти частицы непосредственно присоединяются к центральному иону и называются «лиганды» или «адденды».
Это могут быть:
а) нейтральные молекулы: H2O, NH3, CO, NO;
б) ионы с зарядом -1: OH -, F -, CN -, CNS -, NO2-;
в) ионы с зарядом -2: SO42-, CO32-, S2O32-, C2O42-.
3. Центральный ион и лиганды образуют «внутреннюю координационную сферу» (или «комплексный ион»); ионы, не вошедшие туда, называются «внешняя сфера».
Например: 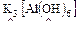
внешняя внутренняя
сфера координационная сфера
4. Ёмкость внутренней сферы ограничена и характеризуется «координационным числом». Координационное число зависит от заряда и радиуса центрального иона, иногда от размера лигандов и может быть различным для некоторых элементов. В зависимости от того, сколько пар электронов может отдать лиганд на связь с центральным атомом и соответственно сколько координационных мест он занимает, лиганды бывают:
а) «монодентатные» - занимают одно координационное место; это или нейтральные молекулы (H2O, NH3, CO, NO);
или ионы с зарядом -1: (OH -, F -, CN -,…).
б) «бидентатные» - занимают два координационных места (SO42-, CO32-,…);
в) «полидентатные» - занимают три и более координационных места (комплексоны ЭДТУ, ЭДТА, …).
Как правило, определённые значения координационных чисел связаны с геометрической конфигурацией комплексного иона:
координационное число = 2 (Ag+, Cu+) – линейное строение;
координационное число = 3 (Mg2+) – плоский треугольник;
координационное число = 4 (Cu2+, В3+, Zn2+) – тетраэдр;
координационное число = 6 (Fe2+, Fe3+, Al3+, Cr3+, Mn4+, Sb5+) – октаэдр.
Реже встречаются комплексы со значениями координационного числа = 8 (Ca2+, Mg2+,…) и координационного числа = 12 (K+, Rb+, …).
Дата добавления: 2017-10-04; просмотров: 1544;











