Общие (коллигативные) свойства растворов
1. Давление пара над раствором (I закон Рауля)
давление над раствором нелетучего растворенного вещества (Pi) всегда меньше, чем над растворителем при той же температуре (Pi0), или
Pi = Pi0 ×nмоль, где nмоль – мольная доля растворенного вещества
2. Температура кипения и замерзания раствора(II закон Рауля)
Ткип раствора выше, чем температура кипения чистого растворителя. Повышение температуры кипения прямо пропорционально моляльности растворенного вещества (Е – эбулиоскопическая постоянная растворителя)
DTкип = i E×m
Ткрист раствора ниже, чем температура кристаллизации чистого растворителя. Понижение температуры кристаллизации прямо пропорционально моляльности растворенного вещества (К – криоскопическая постоянная растворителя)
DTкрист = i K×m
i – изотонический коэффициент, определяющий количество частиц, образующихся в растворе при растворении вещества:
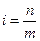 ,
,
где n – общее число частиц в растворе, m – число частиц, подвергшихся растворению. Для неэлектролита i = 1; для электролита i > 1; для коллоидных систем i < 1.
В растворах электролитов изотонический коэффициент связан со степенью диссоциации α:
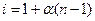
NaCl → Na+ + Cl– n = 2, α = 1, i =2
K2SO4 → 2K+ + SO42– n = 3, α = 1, i =3
3. Осмотическое давление(закон Вант-Гоффа)
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество при данной температуре, находясь в виде газа в объеме раствора.
Росм = i СМ×R×T
Осмос–процесс односторонней диффузии растворителя через полупроницаемую мембрану по градиенту концентрации растворенного вещества.
Осмотическое давление – равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану.
Дата добавления: 2021-09-07; просмотров: 509;











