Водородный показатель – рН
Чистая вода – слабый электролит, ее диссоциацию можно записать как:

 Н2О Н+ + ОН– Кд =
Н2О Н+ + ОН– Кд = 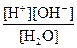 = 1.8∙10–16
= 1.8∙10–16
Степень диссоциации воды чрезвычайно мала (a®0), поэтому [Н2О] – это практически молярная концентрация чистой воды, которая в любом водном растворе является постоянной и составляет [Н2О] ≈ 55,6 М. Следовательно, Кw = КД∙[Н2О] = const, которую называют ионное произведение воды:
Кw = [Н+ ][ОН–]= 10–14
В нейтральном растворе [Н+ ]=[ОН–]=10–7 М.
Для удобства, вместо величины молярной концентрации протонов и гидроксид-инонов, пользуются водородным показателем pH и гидроксидным показателем pOH:
pН = – lg[H+] рОН= – lg[OH-]
Для любого водного раствора при стандартных условиях верно, что рН + рОН =14.
Водородный показатель характеризует среду раствора:
Ø рН < 7 – кислый раствор;
Ø рН = 7 – нейтральный раствор;
Ø рН > 7 – щелочной раствор.
Экспериментально, водородный показатель раствора рН можно определить с помощью индикатора или рН-метра.
Индикатор – сложная органическая кислота или основание, которое меняет свою окраску при изменении рН раствора.
Гидролиз солей.
Основные понятия
Гидролиз соли – это обменная реакция взаимодействия соли с водой с образованием слабого электролита.
Гидролизу подвергаются все соли, за исключением солей, образованных сильным кислотами и сильными основаниями (растворы таких солей нейтральны, рН ≈ 7).
· Соли, образованные слабыми кислотами и сильными основаниями, подвергаются гидролизу по аниону:

 NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
 NO2– + H2O HNO2 + OH– (ионный вид)
NO2– + H2O HNO2 + OH– (ионный вид)
В результате образования гидроксидных ионов растворы таких солей являются щелочными (рН > 7).
· Соли, образованные слабыми основаниями и сильными кислотами , подвергаются гидролизу по катиону:


 NH4Cl + H2O NH4OH + HCl (молекулярный вид)
NH4Cl + H2O NH4OH + HCl (молекулярный вид)
 NH4+ + H2O NH4OH + H+ (ионный вид)
NH4+ + H2O NH4OH + H+ (ионный вид)
В результате образования протонов растворы таких солей являются кислыми (рН < 7).
· Соли, образованные слабыми основаниями и слабыми кислотами, подвергаются полному (необратимому) гидролизу:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Дата добавления: 2021-09-07; просмотров: 561;











