Основы химической кинетики
Основные понятия
Скорость химической реакции (v) – число элементарных актов, происходящих в единице объема или на единице поверхности за единицу времени; в случае реальной химической системы скорость реакции удобнее определять как изменение концентрации реагирующих веществ (реагентов) или образующихся веществ (продуктов) в единицу времени. 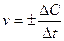
Концентрация – содержание растворенного вещества в единице объема.
Природа вещества – геометрическое и электронное строение молекулы (типы атомов и связей между ними, размеры…).
Гомогенная реакция – реакция, когда все реагирующие вещества находятся в одной фазе; гомогенная реакция протекает по всему объему химической системы.
Гетерогенная реакция – реакция, когда реагирующие вещества находятся в разных фазах; гетерогенная реакция протекает только на границе раздела фаз.
Механизм реакции – последовательность элементарных процессов превращения исходных веществ в продукты реакции.
Элементарный процесс – химическая реакция, протекающая в одну стадию.
Скоростьопределяющая (лимитирующая) стадия – самая медленная стадия механизма реакции.
Кинетическое уравнение реакции – зависимость скорости реакции от концентраций (парциальных давлений) реагирующих веществ.
Порядок реакции по веществу n(i) – экспериментально определяемое число: степень в которую возводится концентрация данного вещества в математическом выражении закона действующих масс; стехиометрические коэффициенты совпадают с порядками реакции только в случае одностадийного процесса.
Суммарный порядок реакции n – сумма всех порядков реакции по веществам, участвующим в реакции.
Константа скорости k –коэффициент пропорциональности в математическом выражении закона действующих масс; удельная скорость при единичных концентрациях веществ; константа скорости зависит только от природы реагирующих веществ и температуры и не зависит от концентраций, давления и объема.
Температурный коэффициент реакции (g) – число, показывающее, во сколько раз возрастет скорость реакции при увеличении температуры на 10°.
Катализатор – вещество, вызывающее изменение скорости химической реакции, но не входящие в стехиометрическое уравнение реакции; катализатор изменяет энергию активации реакции из-за разбиения пути реакции на стадии.
Энергия активации Ea – энергетический барьер, который должны преодолеть исходные вещества для превращения в продукты реакции.
Дата добавления: 2021-09-07; просмотров: 434;











