Площадь границы раздела фаз (для гетерогенных реакций)
при увеличении площади границы раздела фаз (например, при измельчении вещества) скорость реакции возрастает прямо пропорционально увеличению площади.
Температура (правило Вант-Гоффа)
при увеличении температуры на каждые 10 градусов скорость большинства химических реакций возрастает в 2¸4 раза.
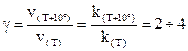 или
или 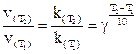
Уравнение Аррениуса
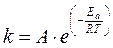
Здесь А – предэкспоненциальный множитель, определяющий зависимость константы скорости от природы реагирующих веществ и от вероятности «удачных» столкновений, приводящих к элементарному акту реакции.
Еа – энергия активации. Величина энергии активации может быть изменена с помощью катализатора. По характеру взаимодействий катализатора и химической системы различают гомогенный, гетерогенный и ферментативный катализ.
Задачи к разделу.
1. Понятие о скорости химической реакции.
2. Какие из следующих факторов влияют на скорость химической реакции (дайте пояснения):
a) природа реагирующих веществ;
b) концентрация реагирующих веществ в растворе;
c) объем раствора;
d) природа растворителя;
e) температура;
f) присутствие катализатора.
3. Напишите выражение для скоростей реакций, протекающих по схеме A + B ¾® AB, если:
a) A и B – газообразные вещества;
b) A и B – жидкости, смешивающиеся в любых отношениях;
c) A и B – вещества, находящиеся в растворе;
d) A – твердое вещество, B – газ или вещество, находящееся в растворе.
4. От каких факторов зависит константа скорости химической реакции? Почему эту величину называют «константой»?
5. Какую размерность имеет константа скорости химической реакции?
6. Влияние температуры на скорость химической реакции. Правило Я.Г. Вант–Гоффа, температурный коэффициент. Уравнение Аррениуса.
7. Может ли температурный коэффициент скорости химической реакции быть отрицательным?
8. Энергия активации, кривая распределения молекул по энергиям. Энергетические схемы химических реакций.
9. Как различаются энергии активации прямой и обратной реакций? Должны ли они различаться по знаку?
10. Кинетическое уравнение химической реакции. Понятие о механизме химической реакции. Порядок и молекулярность химической реакции.
11. Отличаются ли порядок и молекулярность реакции?
12. Могут ли быть реакции нулевого порядка?
13. В чем отличие между общим порядком реакции и порядком по данному веществу?
14. Типы катализа (гомогенный, гетерогенный, ферментативный). Механизмы катализа. Примеры.
15. Какое общее представление лежит в основе объяснения действия катализатора в гомогенном и гетерогенном катализе?
16. Дайте определения следующих понятий:
a) скорость химической реакции;
b) кинетическое уравнение реакции;
c) температурный коэффициент реакции;
d) механизм реакции;
e) порядок химической реакции;
f) молекулярность реакции;
g) лимитирующая стадия реакции;
h) энергия активации.
17. Что отражают стехиометрические коэффициенты в уравнении химической реакции?
18. Предскажите, как изменятся скорости газовых реакций:
1) при увеличении концентрации каждого из реагирующих веществ в 2 раза?
2) при увеличении давления в системе в 2 раза?
a) 2N2O5 ¾® 4NO2 + O2 V = k·[N2O5]
b) 2N2O ¾® 2N2 + O2 V = k·[N2O]2
c) CH3CHO ¾® CH4 + CO V = k·[CH3CHO]2
d) 2NO + O2 ¾® 2NO2 V = k·[NO]2·[O2]
e) F2 + 2ClO2 ¾® 2FClO2 V = k·[F2]·[ClO2]
f) 4H2 + 2NO2 ¾® 4H2O + N2 V = k·[H2]·[ NO2]2.
19. Окисление бромоводорода кислородом в газовой фазе 4HBr + O2 ¾® 2H2O + 2Br2 можно представить стадиями:
HBr + O2 ¾® HOOBr (1)
HOOBr + HBr ¾® 2HOBr (2)
HOBr + HBr ¾® H2O + Br2 (3)
Известно, что увеличение концентрации HBr в 2 раза приводит к увеличению скорости в 2 раза. Увеличение концентрации кислорода в 2 раза также увеличивает скорость в 2 раза. Какая стадия самая медленная? Не вызывает ли у Вас сомнения предложенный механизм?
20. Если реакция 2A+2B ¾® A2B2 протекает по следующему механизму:
2A ® A2 (быстрая, равновесная стадия)
A2 + B ¾® A2B (медленная стадия)
A2B + B ¾® A2B2 (быстрая стадия),
то какова зависимость общей скорости реакции от концентрации веществ A и B?
21. Обсудите правильность следующих утверждений:
a) молекулярность реакции первого порядка равна нулю;
b) молекулярность реакции зависит от ее механизма, тогда как порядок реакции от механизма не зависит.
22. При повышении температуры на 30°C скорость химической реакции возросла в 8 раз. Вычислите температурный коэффициент скорости.
23. Определите энергию активации реакции, для которой при повышении температуры от 295 до 305 К скорость удваивается.
24. Разложение вещества A происходит по двум параллельным стадиям:
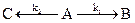
Какова разница в энергиях активации реакций этих стадий, если при 10°C k1/k2 = 0,1. Какая из реакций имеет более высокую энергию активации?
25. Как изменяется концентрация продукта реакции со временем, если реакция имеет нулевой порядок?
26. В реакции A + B ¾® AB получены следующие начальные скорости:
| Нач. Конц. A (моль/л) | Нач. конц. B (моль/л) | Начальная скорость реакции |
| 1.0 | 1.0 | 0.025 |
| 0.1 | 1.0 | 0.0025 |
| 1.0 | 0.1 | 0.00025 |
Напишите кинетическое уравнение реакции.
Дата добавления: 2021-09-07; просмотров: 521;











