Термодинамический подход к состоянию химического равновесия
Изменение свободной энергии Гиббса DG связано со стандартным изменением свободной энергии Гиббса DG0 и концентрациями веществ в химической системе следующим уравнением:
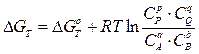
Стандартным изменением энергии Гиббса DG0 называется изменение свободной энергии при стандартных условиях (P0 = 1 атм, Т = 273 К) и концентрациях веществ 1 моль/л.
С позиций термодинамики, равновесие наступает тогда, когда система приходит к минимуму свободной энергии или, другими словами, когда DGТ = 0. В этом случае выражение, находящееся под логарифмом, превращается в константу химического равновесия:
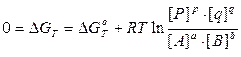

DGТ < 0 – процесс возможен
DGТ > 0 – процесс невозможен
DGТ = 0 – химическое равновесие
DGТ0 < 0, lnKP > 0, KP > 1
DGТ0 > 0, lnKP < 0, KP < 1
DGТ0 = 0, lnKP = 0, KP = 1
DGТ –возможность протекания процесса; DGТ0 – мера протекания процесса (КР).
Равновесие реализуется в интервале DG0 = ±50 кДж.
Задачи к разделу
1. Определите понятия
a) «истинное химическое равновесие»,
b) «ложное химическое равновесие»,
c) равновесие гомогенное и гетерогенное.
2. Сформулируйте закон действующих масс для химического равновесия.
3. Что такое константа химического равновесия?
4. Принцип Ле–Шателье.
5. В системе N2(г) + 3H2(г)  2NH3(г) начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л. Как изменится давление к моменту равновесия, если наступит оно тогда, когда прореагирует 10% первоначального количества азота? Чему равна константа этого равновесия?
2NH3(г) начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л. Как изменится давление к моменту равновесия, если наступит оно тогда, когда прореагирует 10% первоначального количества азота? Чему равна константа этого равновесия?
6. При смешении 1,0 моль HCl с 0,48 моль O2 образовалось 0,40 моль хлора. Давление в системе равно 1 атм. Определите константу равновесия
4HCl(г) + O2(г)  2H2O(г) + 2Cl2(г).
2H2O(г) + 2Cl2(г).
7. Константа равновесия
CO2(г) + H2(г)  CO(г) + H2O(г)
CO(г) + H2O(г)
равна 1. В каких объемных отношениях были смешаны CO2 и H2, если к моменту равновесия 90% водорода превратилось в воду?
8. Константа равновесия
Fe2O3(кр) + 3CO(г)  2Fe(кр) + 3CO2(г)
2Fe(кр) + 3CO2(г)
при температуре T равна 0,4. Исходные концентрации CO и CO2 равны соответственно 0,2 и 0,1 моль/л. Найдите равновесные концентрации.
9. Константа равновесия реакции
2NO(г) + O2(г)  2NO2(г)
2NO2(г)
равна 2,2. Равновесная концентрация оксида азота равна 0,02 моль/л, а диоксида – 0,03 моль/л. Определите исходную концентрацию O2.
10. Исходные концентрации оксида углерода и хлора равны 0,03 и 0,02 моль/л. Равновесная концентрация CO равна 0,021 моль/л. Определите равновесные концентрации хлора и фосгена в реакции
CO(г) + Cl2(г)  COCl2(г).
COCl2(г).
11. Исходная концентрация CO равна 0,05 моль/л, а хлора – 0,06 моль/л. Реакция
CO(г) + Cl2(г)  COCl2(г)
COCl2(г)
протекает в замкнутом сосуде емкостью 1 л. Вычислите исходное давление и давление в момент, когда 50% CO прореагирует, если начальная температура 20°C, а конечная 50°C.
12. Константа равновесия
A(г) + B(г)  C(г) + D(г)
C(г) + D(г)
равна 1. Начальные концентрации A и B равны соответственно 0,02 и 0,10 моль/л. Сколько моль/л A подверглось превращению при данных условиях?
13. Константу равновесия
CO(г) + H2O(г)  CO2(г) + H2(г)
CO2(г) + H2(г)
выразите через константы двух других равновесий:
2CO(г) + О2(г)  2CO2(г) (k1)
2CO2(г) (k1)
2H2(г) + O2(г)  2H2O(г) (k2).
2H2O(г) (k2).
14. Укажите (качественно), какие изменения условий (температура, давление) благоприятствуют смещению равновесий вправо:
a) H2(г) + S(кр)  H2S(г) ∆H° = –40,0 кДж
H2S(г) ∆H° = –40,0 кДж
b) 2O3(г)  3O2(г) ∆H° = –287,7 кДж
3O2(г) ∆H° = –287,7 кДж
c) HCl(г)  H2(г) + Cl2(г) ∆H° = +183,5 кДж
H2(г) + Cl2(г) ∆H° = +183,5 кДж
d) CO2(г) + H2O(г)  HCOOH(г) + O2(г) ∆H° = +517,1 кДж.
HCOOH(г) + O2(г) ∆H° = +517,1 кДж.
15. Оцените, при какой температуре константа равновесия 2SO2(г) + O2(г)  2SO3(г) равна 1. Стандартные энтальпии образования и энтропии этих веществ приведены в приложении.
2SO3(г) равна 1. Стандартные энтальпии образования и энтропии этих веществ приведены в приложении.
16. Оцените температуру, при которой давление диссоциации CaCO3 достигает 1 атм. Какие допущения используются при этой оценке?
17. Константа равновесия Kp реакции
NH4Cl(кр)  NH3(г) + HСl(г)
NH3(г) + HСl(г)
при 25°С равна 10–16, DH°298 реакции равна 177,1 кДж. Найдите температуру, при которой давление диссоциации достигает 1 атм.
18. Константа равновесия реакции
2HI(г)  H2(г) + I2(г)
H2(г) + I2(г)
при 360°C равна 0,0162, а при 445°C равна 0,0240. Вычислите термодинамические характеристики процесса диссоциации йодоводорода.
19. Вычислите начальные концентрации исходных аминокислот, константу равновесия (Кр) и DG0298 реакции образования дипептида: аланин + глицин = аланинглицин, если равновесные концентрации реагентов следующие: [аланин] = [глицин] = 1,5 моль/л, [аланинглицин] = 3·10–3 моль/л.
20. В биологическом полимере имеет место следующее превращение:
нативное состояние  денатурированное состояние
денатурированное состояние
причем при повышении температуры равновесие сдвигается вправо:
a) что можно сказать о знаке DН° в соответствии с принципом Ле-Шателье?
b) если при температуре 60°С величина DG° отрицательна, а DН° положительна, то каков будет знак изменения энтропии этого процесса?
Растворы
Дата добавления: 2021-09-07; просмотров: 553;











