CХЕМА ЭЛЕКТРОЛИЗА ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
1. Электролиз раствора хлорида меди (II) CuCl2
(инертные электроды, водный раствор)
 СuCl2 D Cu2+ + 2Cl–
СuCl2 D Cu2+ + 2Cl–
Катод (–) Cu2+ + 2Cl– ® (+) Анод (С)
Cu2+, H2O H2O Cl–, H2O
Cu2+ + 2 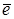 ® Cu0 2Cl– – 2
® Cu0 2Cl– – 2 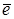 ® Cl2
® Cl2
(восстановление) (окисление)
2. Электролиз раствора сульфата натрия Na2SO4
(инертные электроды, водный раствор)
Na2SO4 D 2Na+ + SO42–


(Pt) Катод (-) 2Na+ + SO42– ® (+) Анод (Pt)
Na+ , H2O H2O SO42– , H2O
2H2O + 2 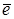 ® H2 + 2OH– 2H2O - 4
® H2 + 2OH– 2H2O - 4 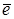 ® O2 + 4H+
® O2 + 4H+
(восстановление) (окисление)
У катода: Na+ + OH– = NaOH У анода: 2H+ + SO42– = H2SO4
3. Электролиз раствора сульфата цинка ZnSO4
(инертные электроды, водный раствор)
ZnSO4 D Zn2+ + SO42–

Катод (-) Zn2+ + SO42– ® (+) Анод (С)
Zn2+, H2O H2O SO42–, H2O
Zn2+ + 2 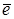 ® Zn0 2H2O - 4
® Zn0 2H2O - 4 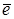 ® O2 + 4H+
® O2 + 4H+
2H2O + 2 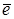 ® H2 + 2OH–
® H2 + 2OH–
(восстановление) (окисление)
4. Электролиз хлорида меди (II) CuCl2
(растворимый медный анод, водный раствор)
СuCl2 D Сu2+ + 2Cl–

Катод (-) Cu2+ + 2Cl– ® (-) Анод
Cu2+, H2O H2O Cl–, H2O
Cu2+ + 2 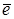 ® Cu0 Cu0 - 2
® Cu0 Cu0 - 2 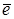 ® Cu2+
® Cu2+
(восстановление) (окисление)
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Схема стандартного водородного электрода:
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Дата добавления: 2019-12-09; просмотров: 1265;











