Ступенчатый гидролиз
В случае солей многоосновных слабых кислот или многокислотных слабых оснований гидролиз протекает ступенчато(или, другими словами, происходит ступенчатый гидролиз многозарядного иона):
(I) 


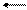 K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–
K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–
(II) 
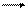

 K2HPO4+ H2O KH2PO4 + KOH HPO42– + H2O H2PO4– + OH–
K2HPO4+ H2O KH2PO4 + KOH HPO42– + H2O H2PO4– + OH–
(III) 
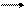

 KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–
KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–
Гидролиз солей характеризуется константой гидролиза Кг и степенью гидролиза h.
Константа гидролиза КГ – характеристика равновесия реакции гидролиза.
Степень гидролиза – доля частиц, подвергшихся гидролизу.
Например, в случае гидролиза сульфида натрия Na2S:
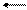
 (I) S2– + H2O HS– + OH–
(I) S2– + H2O HS– + OH– 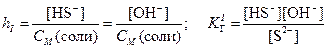
 (II) HS– + H2O H2S + OH–
(II) HS– + H2O H2S + OH– 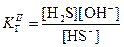
Константа гидролиз связана с ионным произведением воды и соответствующей константой диссоциации слабого электролита. В случае гидролиза сульфида натрия:
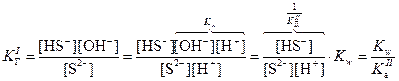

Поскольку 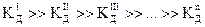 , очевидно, что
, очевидно, что 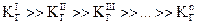 , поэтому в случае таких солей гидролиз протекает только по I ступени.
, поэтому в случае таких солей гидролиз протекает только по I ступени.
Степень гидролиза h связана с константой гидролиза КГ и молярностью раствора соли:
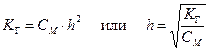 .
.
Гидролиз усиливается:
- при разбавлении раствора;
- при повышении температуры (поскольку реакция гидролиза эндотермическая).
Дата добавления: 2021-09-07; просмотров: 480;











