Тепловой эффект химической реакции
В химических реакциях, кроме выделения или поглощения теплоты, изменяется внутренняя энергия системы и совершается внешняя работа, которая состоит из работы расширения (сжатия) и работы против электрических, магнитных и других сил.
Выделение теплоты в реакции и совершение работы осуществляется за счет уменьшения внутренней энергии системы, которая определяется согласно первому закону термодинамики по уравнению
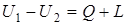 . (6.2)
. (6.2)
При этом уменьшение внутренней энергии U1 – U2 называется тепловым эффектом химической реакции. При обратимых процессах получается максимальная работа и выделяется минимальное количество теплоты
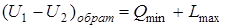 . (6.3)
. (6.3)
В реакциях, в которых совершается только работа расширения или сжатия, а другой работы не совершается, имеет место минимальная работа и максимальная теплота
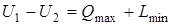 (6.4)
(6.4)
или 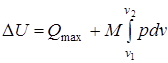 ,
,
где Qmax –теплота реакции; М-масса рабочего тела; 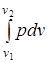 -работа изменения объема;
-работа изменения объема; 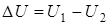 -тепловой эффект реакции.
-тепловой эффект реакции.
Если реакция протекает между твердыми и жидкими веществами, то она почти не сопровождается изменением объема. То же можно сказать про газовые реакции, происходящие в замкнутых оболочках.
В этих случаях, применительно 1 кг рабочего тела, имеем:
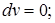
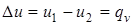 ,
,
т.е. тепловой эффект при постоянном объеме равен количеству выделенной теплоты.
Если химическая реакция протекает при постоянном давлении
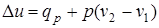 , (6.5)
, (6.5)
т.е. теплота изобарной реакции равна уменьшению энтальпии системы.
Соотношение между qv и qp может быть получено из следующей формулы
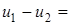
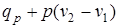 .
.
Изменение ( 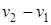 ) объема системы обусловливается почти исключительно возникновением или исчезновением некоторого числа
) объема системы обусловливается почти исключительно возникновением или исчезновением некоторого числа 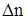 грамм-молекул газообразных веществ, где
грамм-молекул газообразных веществ, где 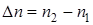 -изменение числа молей вещества в реакции.
-изменение числа молей вещества в реакции.
Так как 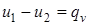 , то
, то
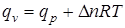 . (6.6)
. (6.6)
В реакциях, где участвуют только конденсированные системы, т.е. твердые и жидкие тела, можно принимать 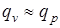 .
.
Тепловые реакции qv и qp зависят от условий (температуры и давления). Для удобства сравнивания и вычисления qv и qp относят к условиям, принятым за стандартные.
Стандартные теплоты реакции вычисляются при р=0,101 МПа и t=25ºС (298 К) и обозначаются 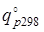 , предлагается, что при этих условиях газы можно рассматривать как идеальные.
, предлагается, что при этих условиях газы можно рассматривать как идеальные.
Закон Гесса. Согласно закону Гесса тепловой эффект химического процесса зависит только от начального и конечного состояния системы, но не зависит от пути, по которому протекает процесс.
Дата добавления: 2021-07-22; просмотров: 586;











