Мера химического сродства
Причиной реакции является химическое сродство реагирующих веществ, т.е. сила их стремления к соединению.
За меру химического сродства принимается максимальная работа реакции, величина которой для реакции 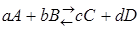 может быть определена по следующим уравнениям:
может быть определена по следующим уравнениям:
При v, Т = const
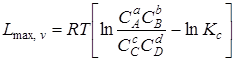
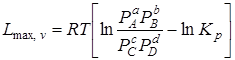 . (6.16)
. (6.16)
При р, Т = const
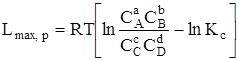
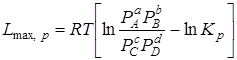 , (6.17)
, (6.17)
где С –начальные концентрации; Р –начальные парциальные давления соответствующих газов.
Эти уравнения позволяют решить вопросы о возможности осуществления реакции при заданных условиях и о направлении реакции. Для этого следует сравнить значение 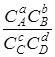 , вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
, вычисленное по заданным начальным концентрациям веществ, со значением константы равновесия Кс, взятым из таблиц для рассматриваемой реакции при заданных условиях.
Если 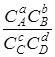 >Kc, т.е. Lmax > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
>Kc, т.е. Lmax > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
Если 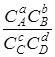 <Kc, т.е. Lmax < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если Lmax = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
<Kc, т.е. Lmax < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если Lmax = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
Ввиду того, что максимальная работа одной и той же реакции при одной и той же температуре есть величина переменная, зависящая от начальных концентраций веществ, для оценки химического сродства максимальные работы различных реакций берутся при начальных концентрациях всех веществ, равных единице. При этом
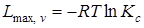
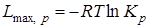 ,
,
 .
.
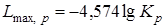 (6.18)
(6.18)
Последнее уравнение может быть применено для вычисления уменьшения свободной энергии и термодинамического потенциала, так как
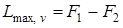 ;
; 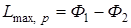 ;
;
при этом
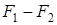
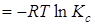 =
= 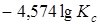
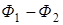
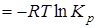 =
= 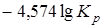 .
.
Закон Нернста (тепловая теорема).Согласно закону Нернста вблизи абсолютного нуля в реакциях, протекающих в конденсированных системах, равны максимальные работы и тепловые эффекты:
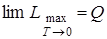 ,
,
а также
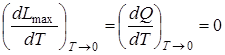 . (6.19)
. (6.19)
По закону Нернста постоянная интегрирования в уравнениях константы равновесия и максимальной работы для конденсированных систем равна нулю.
Следствие тепловой теоремы:
1. При абсолютном нуле теплоемкость сi конденсированных тел равна нулю:
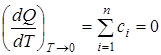 .
.
Опытные данные позволяют предположить, что при абсолютном нуле не только алгебраическая сумма теплоемкостей, но и теплоемкость каждого тела в отдельности равна нулю.
2. При абсолютном нуле энтропия конденсированных тел равна нулю:
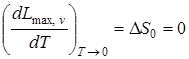 .
.
Вопросы для самопроверки
1. Как определяется максимальная работа изохорно-изотермических и изобарно-изотермических реакций?
2. Выведите уравнение изотермы химической реакции.
3. Сформулируйте закон Вант - Гоффа.
4. Сформулируйте тепловой закон Нернста.
5. Покажите, что из закона Нернста следует принципиальная недостижимость абсолютного нуля температуры.
Глоссарий
(словарь терминов)
Термодинамические параметры состояния – численные значения величин, характеризующие состояние рабочего тела (термодинамической системы тел)
Абсолютная температура тела, Т – температура, отчитываемая от абсолютного нуля, равного – 273,16 °С. Единица измерения Т – Кельвин.
Абсолютное давление тела, Р – давление, отсчитываемое от нуля, равное сумме барометрического (атмосферного) давления Р0 и избыточного (манометрического) Ризб.
Удельный объем, V – объем единицы массы рабочего тела.
Термодинамический процесс – совокупность последовательных состояний, через которое проходит рабочее тело при взаимодействии с окружающей средой.
Внутренняя энергия тела, U – энергия всех составляющих тело микрочастиц и равна сумме их кинетической энергии.
Теплота, ΔQ – микроскопическая форма обмена энергией между рабочим телом и окружающей средой, без изменения формы и объема, при этом изменяются значения давления и температуры системы.
Работа, ΔL – макроскопическая форма обмена энергии между рабочим телом, совершаемого по преодолению сопротивления окружающей среды, при этом изменяются значения всех параметров состояния.
Энтальпия, Н – функция состояния равная сумме энергии (U) и потенциальной энергии, в виде произведения давления (Р) на объеме (V) рабочего тела. Изменение энтальпии в любом термодинамическом процессе определяется начальным и конечным состоянием рабочего тела.
Энтропия, S – функция состояния, дифференциал (dS), которой для термодинамического процесса равен отношению бесконечно малого количества теплоты (  ) сообщаемого рабочему телу к его абсолютной температуре (Т).
) сообщаемого рабочему телу к его абсолютной температуре (Т).
Цикл действительный (реальный) – необратимый цикл, осуществляемый реальным рабочим телом, в котором изменяются теплоемкость и химический состав, теплота подводится в результате сжигания топлива и отвод теплоты осуществляется в виде выпуска продуктов сгорания, уносящих теплоты в окружающую среду.
Цикл Карно – цикл состоящий из двух изотермических и двух адиабатных процессов.
Термический к.п.д.– отношение произведенной работы (lп) к подведенной теплоте (qп) или отношение теплоты превращенной в работу ко всей подведенной теплоте, т.е. 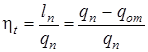 , где qот – отведенная теплота.
, где qот – отведенная теплота.
Дросселирование – необратимый процесс протекания газа через местное сопротивление (суженное сечение), в результате которого уменьшается давление газа без совершения технической работы.
Цикл двигателя внутреннего сгорания (ДВС)– тепловой двигатель, у которого все процессы получения теплоты, выделяющейся при сжигании топлива, и преобразования её в механическую работу осуществляется непосредственно внутри цилиндра.
Цикл газотурбинной установки– тепловой двигатель, у которого процесс получения теплоты, выделяющейся при сжигании топлива, осуществляется в изолированной камере сгорания, а преобразование теплоты в механическую работу происходит в сопловой решетке и на лопатках газовой турбины.
Цикл Ренкина– цикл, состоящий из двух адиабатных процессов, соответствующих расширению пара на лопатках паровой турбины и повышению давления воды в насосе, а также двух изобарно – изотермических процессов, соответствующих конденсации отработавшего пара, нагреву воды до кипения и превращению кипящей воды в сухой насыщенный пар (или перегретый пар).
Цикл паротурбинной установки– тепловой двигатель, у которого процесс получения теплоты, выделяющейся при сжигании топлива, осуществляется в топке котла, нагрев воды и получения пара в паровом котле и пароперегревателе, а преобразование тепловой энергии пара в механическую работу происходит в сопловой решетке и на лопатках паровой турбины.
Испарение – процесс образования пара, происходящий с поверхности жидкости при любой температуре.
Кипение – процесс образования пара, происходящий по всей массе жидкости при температуре кипения.
Пар – реальный газ близкий к состоянию насыщения, т.е. к превращению в жидкость.
Влажный насыщенный пар – пар, который получается при неполном испарении жидкости.
Сухой насыщенный пар – пар, который получается при полном испарении всей жидкости.
Перегретый пар – пар, температура которого выше температуры насыщенного пара того же давления.
Степень сухости пара, Х – доля массы сухого насыщенного пара в 1 кг влажного пара.
Степень перегрева – разность между температурой перегретого пара и температурой сухого насыщенного пара того же давления.
Скрытая теплота парообразования, r – количество теплоты, которое необходимо сообщить при постоянном давлении нагретой до кипения 1 кг жидкости для её превращений в сухой насыщенный пар.
Влажный воздух – смесь сухого воздуха с водяным паром.
Изопараметрический процесс – процесс, протекающий при постоянном значении одного из параметров состояния (Р, Т, V = const).
Изохорный процесс – процесс, протекающий при постоянном объеме (V = const, dv = 0).
Изобарный процесс – процесс, протекающий при постоянном давлении (Р = const, dР = 0).
Изотермический процесс – процесс, протекающий при постоянной температуре (Т = const, dТ = 0).
Адиабатный процесс – процесс, протекающий без теплообмена с окружающей средой (dq = 0).
Политропный процесс – процесс, протекающий при наличии теплообмена с окружающей средой.
Цикл – совокупность последовательных процессов, в результате которых термодинамическая система, выведенная из некоторого состояния возвращается в исходное состояние и совершается работа.
Цикл термодинамический (идеальный) – совокупность термодинамических процессов, в котором теплоемкость, химический состав и объем рабочего тела не меняются, процессы сжатия и расширения адиабаты, процессы сгорания и газообмена заменяются на условные процессы подвода и отвода теплоты.
Идеальный газ – газ, между молекулами которого отсутствует взаимодействие, объем молекулы очень мал по сравнению с объемом всего газа и молекулы рассматриваются как беспорядочно-движущиеся материальные точки.
Реальный газ – газ, между молекулами которого существуют силы взаимодействия и молекулы имеют конечный объем.
Уравнение состояния – устанавливает функциональную зависимость параметров состояния рабочего тела (идеального или реального газа) в виде f(P, V, T)= 0.
Теплоемкость, с – отношение подведенного к рабочему телу количества теплоты (ΔQ) к достигнутой при изменении состояния разности температур тела (ΔТ), т.е. 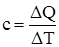 .
.
Газовая смесь – механическая смесь отдельных компонентов различных газов, химически не реагирующих между собой.
Первый закон термодинамики – теплота (  ), подведенная к рабочему телу с массой (m), идет на приращение внутренней энергии (dU) и совершение работы расширения (
), подведенная к рабочему телу с массой (m), идет на приращение внутренней энергии (dU) и совершение работы расширения (  ) против сил окружающей среды, т.е.
) против сил окружающей среды, т.е.
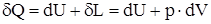
Второй закон термодинамики – двигатель, полностью превращающий в работу всю полученную от горячего источника теплоту не возможен, т.е. теплота, полученная рабочим телом от горячего источника, не может быть полностью превращена в механическую работу, часть её должна быть отдана холодному источнику теплоты.
Энергия – максимально возможная работа, которую может совершить система, за счет теплоты (q1) в любых обратимых процессах, при переходе из заданного состояния до полного равновесия с окружающей средой, т.е. 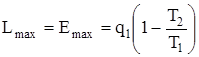 .
.
Фазовое равновесие – одновременное существование термодинамических равновесных фаз в многофазной системе, например, равновесие жидкости со своим паром, равновесие льда и воды и т.д.
Фазовый переход – переход вещества из одной фазы в другую при изменении температуры, давления и т.д.
Тройная точка – точка, в которой находятся в равновесии три фазы вещества, параметры тройной точки называются критическими.
УЧЕБНОЕ ПОСОБИЕ
В качестве учебного пособия рекомендуется использовать учебники [1], [3].
Дата добавления: 2021-07-22; просмотров: 547;











