Константа химического равновесия
Скорость прямой реакции w1 непрерывно уменьшается, а скорость обратной реакции w2 непрерывно увеличивается, и в тот момент, когда скорость обратной реакции становится равной скорости прямой реакции, наступает химическое равновесие: w1 =w2.
Рассмотрим реакцию
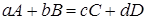 .
.
Если концентрация веществ при химическом равновесии обозначить сА, сВ, сС и сD, причем 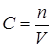 (для идеальной газовой системы), то
(для идеальной газовой системы), то
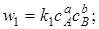
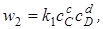
где k1 и k2 –константы скорости прямой и обратной реакций.
При химическом равновесии w1 =w2, т.е.
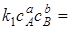
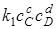 ;
;
и
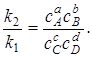
Отношение 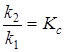 -константа равновесия химической реакции:
-константа равновесия химической реакции:
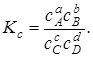 (6.11)
(6.11)
Выражение константы равновесия может быть представлено через парциальные давления (для идеальной газовой системы):
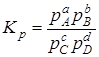 , (6.12)
, (6.12)
где рА, рВ, рС и рD –парциальные давления отдельных газов в смеси при химическом равновесии.
Константы Кс и Кр связаны зависимостью
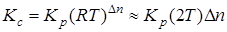 , (6.13)
, (6.13)
где 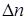 -изменение числа молей в реакции.
-изменение числа молей в реакции.
Для реакции 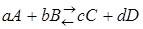
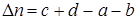 .
.
Например, для реакции
СО + Н2О  Н2 + СО2
Н2 + СО2
при 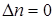 Кс = Кр; при
Кс = Кр; при 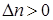 Кс > Кр; при
Кс > Кр; при 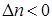 Кс < Кр.
Кс < Кр.
Зависимость констант равновесия от температуры:
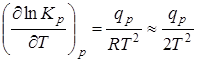 ,
,
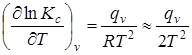 (6.14)
(6.14)
Приведенные уравнения показывают, что знак изменения константы равновесия при увеличении температуры зависит от знака теплоты реакции (Закон Вант-Гоффа).
Из закона Вант-Гоффа следует, что в экзотермических реакциях тепловой эффект положителен (q > 0) и, следовательно, 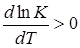 . В таких реакциях при увеличении температуры увеличивается и константа равновесия К. Увеличение последней означает, что при равновесии возрастает концентрация исходных веществ и убывает концентрация веществ, получаемых в реакции, т.е. для осуществления экзотермических реакций благоприятны низкие температуры.
. В таких реакциях при увеличении температуры увеличивается и константа равновесия К. Увеличение последней означает, что при равновесии возрастает концентрация исходных веществ и убывает концентрация веществ, получаемых в реакции, т.е. для осуществления экзотермических реакций благоприятны низкие температуры.
В эндотермических реакциях тепловой эффект отрицателен (q < 0) и в них при увеличении температуры константа равновесия уменьшается 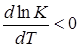 . Это означает, что при равновесии уменьшается концентрация начальных веществ и увеличивается концентрация полученных веществ, т.е. для эндотермических реакций благоприятны высокие температуры.
. Это означает, что при равновесии уменьшается концентрация начальных веществ и увеличивается концентрация полученных веществ, т.е. для эндотермических реакций благоприятны высокие температуры.
Зависимость констант равновесия от температуры может быть выражена следующим образом:
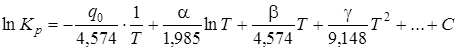 , (6.15)
, (6.15)
где q0 –тепловой эффект при абсолютном нуле температуры (можно определить исходя из значений q298 при стандартных условиях), а С –константа интегрирования, определяемая в соответствии с законом Нернста.
В конденсированных системах С = 0 (закон Нернста).
Таблица 6.1
Химические константы i и условные
химические константы j
| Вещество | Химическая константа i | Условная химическая константа j |
| Н2 | -368 | +1,6 |
| N2 | -3,11 | +2,6 |
| Вещество | Химическая константа i | Условная химическая константа j |
| O2 | +0,65 | +2,8 |
| CO | -0,07 | +3,5 |
| CO2 | +0,8 | +3,2 |
| H2O | +1,95 | +3,6 |
| CH4 | -1,96 | +2,5 |
| NO | +0,52 | +3,5 |
| N2 | -3,11 | +2,6 |
В газовых системах
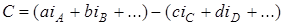 ,
,
где i –химические константы соответствующих веществ (табл. 6.1).
Иногда принимают приближенное уравнение
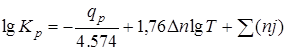 ,
,
где qp –тепловой эффект при комнатной температуре и
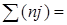
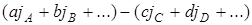 ,
,
где j –условные химические константы соответствующих веществ.
Ориентировочно можно принимать j = 1,5 для одноатомных газов и водорода и j = 3,0 для двух- и многоатомных газов.
От давления константы равновесия зависят незначительно, и при не очень высоких давлениях зависимостью Кс и Кр от давления пренебрегают.
Диссоциация
Диссоциацией называется распад соединения на более простые вещества, которыми в частном случае могут быть химические элементы.
Степенью диссоциации называется доля моля вещества, разложившегося к началу равновесия. Степень диссоциации обозначается через 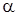 .
.
1. Если реакция сопровождается увеличением числа молей, то степень диссоциации увеличивается при повышении давления.
2. Если реакция сопровождается уменьшением числа молей, то степень диссоциации уменьшается при повышении давления.
3. Если реакция происходит без изменения числа молей, то степень диссоциации не изменяется при повышении давления (при определении числа молей твердые вещества во внимание не принимаются).
Вопросы для самопроверки
1. Сколько параметров могут оставаться постоянными при протекании в системе химической реакции?
2. Запишите первый закон термодинамики для химически активной системы.
3. Что такое тепловой эффект химической реакции?
4. Как связаны тепловые эффекты изохорно –изотермических Qv и изобарно –изотермических Qp реакций?
5. Сформулируйте закон Гесса и его основные следствия.
6. Каким законом определяется зависимость теплового эффекта химической реакции от температуры, при которой она протекает?
7. Что такое скорость химической реакции?
8. Сформулируйте закон действующих масс.
9. Что такое химическая обратимость реакции?
10. Дайте определение констант равновесия Кс и Кр. Какая связь существует между этими величинами?
11. Каким способом, зная константу равновесия, вычислить равновесный состав?
12. Что такое степень диссоциации и как она связана с константой равновесия?
13. Как зависит от давления степень диссоциации у реакций, протекающих с изменением и без изменения количества вещества?
Дата добавления: 2021-07-22; просмотров: 463;











