Раздел 6. Элементы химической термодинамики
Раздел содержит две темы и вопросы для самопроверки.
Законы термодинамики в термохимии
Первый закон термодинамики в термохимии. Тепловой эффект химической реакции. Закон Гесса и его следствия. Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа). Стандартный тепловой эффект. Второй закон термодинамики в термохимии. Закон действующим масс. Химическое равновесие. Константа равновесия. Степень диссоциации. Свободная энергия и изобарный потенциал (свободная энтальпия) как характеристические функции.
По теме не предусмотрены практические занятия, лабораторные и контрольные работы.
После изучения теоретического материалы следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
Основные понятия химической термодинамики
Известно, что молекулы всех веществ состоят из атомов химических элементов, находящихся в определенных соотношениях. Любое вещество состоит из однородных молекул и обладает определенными физическими и химическими свойствами, зависящими от структуры молекул. Если под влиянием каких –либо факторов (теплоты, света, электрического тока и т.д.) структура молекулы изменяется, то данное вещество перестает существовать, а появляется новое вещество с другими свойствами. Процесс превращения одних веществ в другие называется химической реакцией, а участвующие в этом процессе вещества называются компонентами химической реакции.
Химическая реакция может происходить между веществами, находящимися в однофазном (гомогенные реакции) и многофазном (гетерогенные реакции) состояниях. Уравнение реакции, выражающее эквивалентные соотношения между компонентами, называется стехиометрическим уравнением. Молярные (массовые) соотношения между эквивалентными количествами компонентов реакции называются стехиометрическими соотношениями, а смесь, состоящая из компонентов, называется стехиометрической смесью.
Химические реакции сопровождаются обычно выделением (экзотермические) или поглощением (эндотермические) теплоты, которая называется теплотой реакции - Q. Соответственно выделяющая теплота считается положительной, а поглощаемая –отрицательной.
В общем виде формула химической реакции запишется
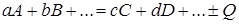 , (6.1)
, (6.1)
где A, B, C, D –компоненты химической реакции; a, b, c , d –коэффициент эквивалентности.
Известно, что основными горючими компонентами органического топлива являются углерод (С) и водород (Н), которые вступают в химическую реакцию с кислородом в определенных соотношениях и рассчитываются по стехиометрическим уравнениям горения следующего вида:
-уравнение окисления углерода C + O2 = CO2 + Qн или при расчете
в массовых долях 1С+2,67О2 = 3,67СО2 +33,7 МДж/кг
в объемных долях 1С +1,866О2 = 1,867СО2 +33,7 МДж/кг
-уравнение окисления водорода 2H2 + O2 = 2H2O + QH или при расчете
в массовых долях 1Н2 +8О2= 9Н2О +142,4 МДж/кг
в объемных долях 1Н2 +5,6О2 = 11,2Н2О +142,4 МДж/кг
При этом коэффициенты эквивалентности горючих компонентов получены из соотношения молярных масс, соответственно уравнение окисления углерода- 1=12/12, кг/кг; 2,67=32/12, кг/кг; 3,67=44/12, кг/кг и для объемных долей, с учетом 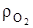 =1,428, кг/м3 –плотность кислорода и
=1,428, кг/м3 –плотность кислорода и 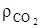 =1,964, кг/м3 при нормальных условиях, 2,67/1,428=1,866, м3/кг; 3,67/1,964=1,867 м3/кг.
=1,964, кг/м3 при нормальных условиях, 2,67/1,428=1,866, м3/кг; 3,67/1,964=1,867 м3/кг.
Аналогично рассчитываются коэффициенты в уравнении окисления водорода -1=4/4, кг/кг; 8=32/4, кг/кг; 9=36/4, кг/кг и для объемных долей, с учетом 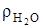 =0,805, кг/м3;5,6=8/1,428, м3/кг; 11,2=9/0,805, м3/кг.
=0,805, кг/м3;5,6=8/1,428, м3/кг; 11,2=9/0,805, м3/кг.
В каждой протекающей химической реакции образуется смесь, состоящая из исходных компонентов и продуктов сгорания, которая представляет собой замкнутую термодинамическую систему. Содержание компонентов реакции в этой системе изменяется с течением времени в сторону уменьшения для исходных веществ и в сторону увеличения для конечных веществ. Для характеристики состава многокомпонентной смеси используется концентрация компонентов, под которой понимается количество молекул (или киломолей) в единице объема реагирующей системы.
Таким образом состояние реагирующей системы определяется термодинамическими параметрами –давлением и температурой, а также концентрацией компонентов.
Дата добавления: 2021-07-22; просмотров: 578;











