Свойства катализаторов
Свойства катализаторов: (kt)
1) катализатор не влияет на положение термодинамического равновесия, т.е на величину константы равновесия
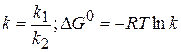 (1.85)
(1.85)
2) катализаторы обладают избирательностью (или селективностью действия). Каждый катализатор может ускорять лишь некоторые реакции.
Ni – катализатор реакции гидрирования
V2O5 – катализатор реакции окисления
Для каталитического действия обычно достаточно малое количество катализатора. Влияние kt на скорость процесса характеризуется удельной каталитической активностью, за меру которой принимается скорость реакции в присутствии kt, отнесенная к единице количества kt (гомогенный катализ) или к единице поверхности kt (гетерогенный катализ). 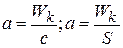
Механизм действия kt очень сложный. В присутствии kt:
1) снижается величина Eакт;
2) увеличивается скорость реакции;
3) kt может вызвать цепные реакции;
4) делает более вероятным протекание некоторых реакций.
Рассмотрим влияние катализатора на кинетику химических реакций на примере гомогенно-каталитической бимолекулярной односторонней реакции
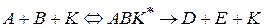
Константа равновесия образования активного комплекса 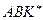 равна
равна
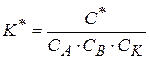 (1.86)
(1.86)
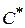 - концентрация активных комплексов;
- концентрация активных комплексов;
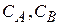 - концентрация исходных веществ;
- концентрация исходных веществ;
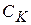 - концентрация катализатора, не вошедшего в активный комплекс.
- концентрация катализатора, не вошедшего в активный комплекс.
Скорость реакции в присутствии катализатора
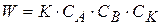 (1.87)
(1.87)
Из уравнения (1.86) значение 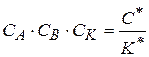 , его подставим в уравнение (1.87), тогда
, его подставим в уравнение (1.87), тогда
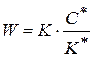 (1.88)
(1.88)
Концентрация свободного катализатора 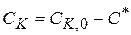
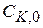 - общая или исходная концентрация катализатора
- общая или исходная концентрация катализатора
Из уравнения (1.86) выразим отношение 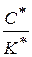 :
:
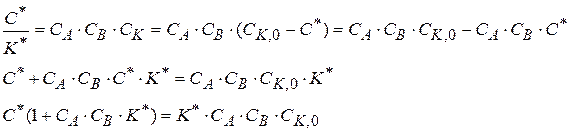
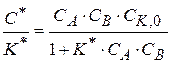 (1.89)
(1.89)
Подставим это значение 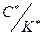 в уравнение скорости реакции
в уравнение скорости реакции
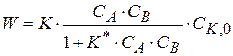 (1.90)
(1.90)
Уравнение (1.90) показывает, что скорость гомогенно-каталитической бимолекулярной реакции пропорциональна концентрации катализатора 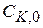 .
.
Анализ уравнения:
1) при малых значениях 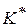 можно принять, что сумма
можно принять, что сумма 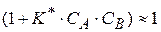 , тогда уравнение (1.90) можно записать
, тогда уравнение (1.90) можно записать
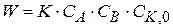 (1.91)
(1.91)
Общий порядок реакции по исходным веществам – второй, а по веществам A или B – первый.
2) если значение 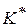 велико, то
велико, то 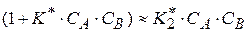 и скорость реакции
и скорость реакции
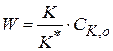 (1.92)
(1.92)
При этом реакция протекает по нулевому порядку (по исходным веществам).
3) при средних значениях 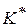 порядок реакции по исходным веществам будет дробный.
порядок реакции по исходным веществам будет дробный.
Если каталитическая реакция
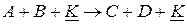
протекает в две стадии с образованием неустойчивого промежуточного соединения AK
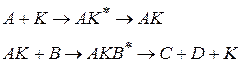
то скорость реакции выражается уравнением (1.90)
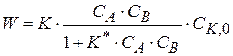 (1.93)
(1.93)
В присутствии катализатора может протекать термодинамически возможная реакция по новому пути с образованием других продуктов 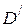 и
и 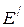 , которые без катализатора практически не образуются
, которые без катализатора практически не образуются
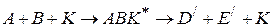
или 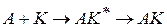
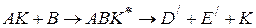
При образовании активного комплекса в присутствии катализатора энтропия активации уменьшается в присутствии kt по сравнению с энтропией активации без kt. Это приводит к уменьшению константы скорости реакции. Т.о., увеличение константы скорости реакции может быть связана только с уменьшением энергии активации реакции.
Константа скорости реакции образования активного комплекса может быть рассчитана по формуле
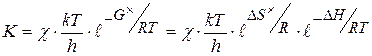 (1.94)
(1.94)
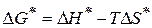 - изобарный потенциал активации
- изобарный потенциал активации
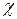 - трансмиссионный коэффициент прохождения (≈1), для приближенных расчетов можно не учитывать
- трансмиссионный коэффициент прохождения (≈1), для приближенных расчетов можно не учитывать
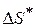 - энтропия образования активного комплекса
- энтропия образования активного комплекса
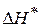 - энтальпия образования активного комплекса
- энтальпия образования активного комплекса
k - const Больцмана
h - const Планка
T - температура
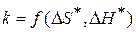 - зависит от энтальпии и энтропии активации.
- зависит от энтальпии и энтропии активации.
Дата добавления: 2017-03-12; просмотров: 2818;











