Логарифмический закон окисления
При образовании тонких защитных оксидных пленок на некоторых металлах (на Cu до 100°С; на Ta до 150°С; на Al, Zn при 25-225°С; на Fe до 3750С; на Ni до 6500С и др.) наблюдается большее самоторможение, чем при обычном диффузионном контроле окисления. Этим процессам соответствует логарифмический закон роста пленки:
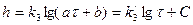 , (2.34)
, (2.34)
где k3,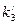 , a, b и С – постоянные.
, a, b и С – постоянные.
Согласно теории Хауффе и Ильшнера, скорость образования очень тонких пленок может контролироваться переносом электронов через оксидную пленку путем туннельного эффекта. Число электронов массой m и кинетической энергией E= ½ mv2, (v - составляющая скорости в направлении, нормальном к энергетическому барьеру), проходящих сквозь прямоугольный энергетический барьер высотой U и шириной h, определяется по уравнению:
 , (2.35)
, (2.35)
где 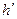 - постоянная Планка. Скорость образования оксидной пленки пропорциональна этой величине:
- постоянная Планка. Скорость образования оксидной пленки пропорциональна этой величине:  , (2.36)
, (2.36)
где k5 – коэффициент пропорциональности,  . Разделяя переменные, интегрируем (2.35):
. Разделяя переменные, интегрируем (2.35):  . Принимая, что рост пленки начинается в момент времени τ = 0, когда h = 0:
. Принимая, что рост пленки начинается в момент времени τ = 0, когда h = 0: 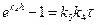 , логарифмируя, получаем уравнение:
, логарифмируя, получаем уравнение:
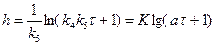 , (2.37)
, (2.37)
где К – коэффициент, а – постоянная времени [τ-1].
Для нахождения констант в уравнении логарифмического закона (2.34) строят график в координатах h=f(lgτ), которая для логарифмической зависимости дает прямую 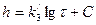 ,где
,где 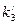 = tg a, C – отрезок на оси ординат при lgτ = 0.
= tg a, C – отрезок на оси ординат при lgτ = 0.
По теории Мотта и Кабреры, скорость переноса электронов через оксидный слой путем туннельного эффекта больше скорости переноса ионов. Слой оксида с двух сторон ограничен поверхностными зарядами (отрицательным на границе металл - газ и положительным на границе металл - оксид), между которыми образуется однородное электрическое поле. Контролирующей стадией суммарного процесса окисления является перенос ионов металла под влиянием электрического поля при высоком градиенте потенциала. Эта теория позволяет получить обратный логарифмический закон:
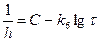 , (2.38)
, (2.38)
где k6 и С – постоянные.
Уравнения 2.34, 2.38 характеризуют окисление с очень быстрым торможением, соответствующим скорости окисления: 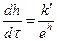 , (2.39)
, (2.39)
где 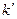 - постоянная. Данный механизм реализуется при образовании очень тонких защитных оксидных пленок. Схематично можно представить механизм процесса следующим образом. На металлах, оксиды которых не имеют электронной проводимости, перенос электронов из металла через тонкий слой оксида наружу идет по туннельному механизму (возможность преодоления электронами с максимальной энергией, но недостаточной для преодоления барьера – пленки) что возможно для очень тонких пленок (до 10 нм). При этом возникает значительный градиент потенциала в пленке, что в начальный момент стимулирует движение (миграцию) ионов и рост пленки. С ростом пленки свыше 10 нм интенсивность туннельного переноса электронов убывает по показательной функции, что приводит к снижению градиента E в пленке, соответствующему уменьшению скорости миграции ионов через пленку, и, следовательно, к резкому уменьшению скорости окисления.
- постоянная. Данный механизм реализуется при образовании очень тонких защитных оксидных пленок. Схематично можно представить механизм процесса следующим образом. На металлах, оксиды которых не имеют электронной проводимости, перенос электронов из металла через тонкий слой оксида наружу идет по туннельному механизму (возможность преодоления электронами с максимальной энергией, но недостаточной для преодоления барьера – пленки) что возможно для очень тонких пленок (до 10 нм). При этом возникает значительный градиент потенциала в пленке, что в начальный момент стимулирует движение (миграцию) ионов и рост пленки. С ростом пленки свыше 10 нм интенсивность туннельного переноса электронов убывает по показательной функции, что приводит к снижению градиента E в пленке, соответствующему уменьшению скорости миграции ионов через пленку, и, следовательно, к резкому уменьшению скорости окисления.
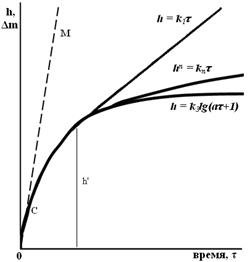
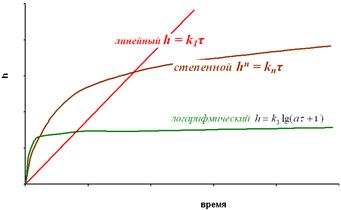
Основные законы окисления приведены на рис. 2.7.
а б
Рис.2.7. Основные законы окисления: а – начальный этап роста оксидных пленок, б – законы роста пленок.
В начальный момент окисления на чистой поверхности металла рост пленки в основном определяется константой скорости химической реакции. На участке 0С кривые окисления близки к прямой 0М, тангенс угла наклона которой пропорционален скорости химической реакции. Выше точки С ход кривых определяется переходным периодом, когда диффузионное торможение мало и соизмеримо с торможением химической реакции. Здесь окисление определяется уравнением hn = knτ, где 1<n<2. С дальнейшим утолщением пленки после точки С, ее рост приближается к чисто параболическому закону окисления h2 = k2 τ с диффузионным контролем процесса. Если пленка по достижении критической толщины h' утолщается, образуя на внешней поверхности несплошную рыхлую пленку, то, начиная с этого момента окисление идет по линейному закону h=k1τ.
При окислении, по мере роста пленки, кроме её утолщения, могут появиться дополнительные причины, замедляющие скорость роста. Если замедлена встречная миграция ионов в пленке (например, из-за прекращения туннельного перехода электронов сквозь защитную пленку), начиная с момента появления дополнительного сопротивления встречной диффузии реагентов, кривая будет идти ниже и соответствовать логарифмической зависимости 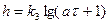 , что характерно для металлов Al, Сг, Zn.
, что характерно для металлов Al, Сг, Zn.
Дата добавления: 2017-02-13; просмотров: 3454;











