Влияние состава газовой среды
При высоких температурах металлы могут взаимодействовать с кислородом (mМ+n/2 O2=MmOn), парами воды (mM + nH2O = MmOn + nH2), диоксидом углерода (mМ+nСО2=МmОn+nСО), парообразной серой, диоксидом серы (3M+SO2=2MO+MS), сернистыми соединениями, галогенами (особенно Cl2, Br2). Скорость газовой коррозии ряда металлов в некоторых средах приведена на рис.2.12, где наиболее жаростоек Cr.
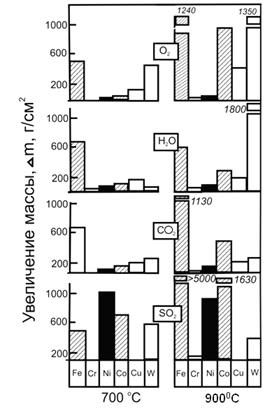
Рис.2.12. Скорость окисления некоторых металлов в О2, Н2О, СО2, SO2 при различных температурах, (24 ч).
Ni устойчив в О2, Н2О, СО2, но имеет низкую жаростойкость в SO2, где наиболее устойчива медь. Скорость окисления Fe в этих средах примерно соизмерима при 7000С, при 9000С сильно окисляется в SO2 (влияние состава газовой чреды на скорость окисления стали приведена в табл.). Из других металлов в кислороде особенно стоек Al и его сплавы, но его скорость окисления резко возрастает при наличии Cl2.
Таблица 2.2
Влияние состава газовой среды на скорость коррозии стали (0,17% С) при 900°С
| Газовая среда | Относительная скорость коррозии, % |
| воздух | |
| воздух + 2% SО2 | |
| воздух +5% Н2О | |
| Кислород | |
| воздух +5% SО2 + 5% Н2О |
Окисление сплавов
При окислении двухкомпонентного сплава хМ1+уМ2, состоящего из менее благородного (менее термодинамически устойчивого по величине ΔGT) металла М1, и более благородного, М2, с соответствующими концентрациями х и у, более склонен к окислению менее термодинамически устойчивый компонент М1. Окисление сплава может протекать по механизму избирательного окисления, когда окислитель взаимодействует только с одним компонентом сплава (например Ni в сплаве Ni – Pt), и по механизму предпочтительного окисления, когда скорость окисления компонентов различна. Состав образующихся оксидов зависит от концентрации исходных компонентов:
1) при у»х на поверхности сплава образуется оксид более благородного металла М2О, в котором может находиться в растворе соединения металла М1;
2) при х»у на поверхности образуется соединение более благородного М2, твердый раствор которого может содержать менее благородный металл М1;
3) при х≈у на поверхности сплава могут образовываться как отдельные слои соединений компонентов сплава, так и слои смеси оксидов компонентов сплава, или же оксиды типа шпинели (М1М2)2О4.
При окислении сплавов наряду с образованием поверхностного окисного слоя (окалины) возможно образование “подокалины” – слоя, обогащенного более термодинамически устойчивым металлом М2, содержащего вкрапления оксидов менее стойкого металла М1. Это - внутреннее окисление, заключающееся в избирательном окислении наименее термодинамически стойкого легирующего компонента (М1), которое происходит в сплаве вблизи границы раздела сплав – окислитель. Оно обусловлено превышением диффузионного потока окислителя вглубь сплава над встречным потоком легирующего компонента, в результате чего частицы оксидов образуются внутри сплава, под слоем недостаточно защитной оксидной пленки. Внутреннее окисление развивается в подокалинном слое при достаточной растворимости окислителя (кислород, азот, углерод, водород) в основном металле. Оно наблюдается в Cu, Ag при “низком” легировании (до 1 – 3 %) Al, Si, Ti; в Ni при легировании Al, Cr, Fe, и др. сплавах.
Образование тонких дисперсных частиц оксидов в сплаве обуславливает упрочнение сплавов при азотировании, цементации и т.д., а также дает возможность получения дисперсно-упрочненных сплавов.
Катастрофическое окисление - неожиданно быстрое окисление металлов. Может быть вызвано: 1) потерей изотермичности условий в зоне окисления, вследствие чего температура в зоне реакции непрерывно возрастает и металл начинает окисляться с возрастающей скоростью. Металлы, окисляющиеся по линейному закону, имеют тенденцию к катастрофическому окислению, если выделяющееся тепло экзотермической реакции окисления металла не успевает рассеиваться, и температура поверхности металла возрастает, непрерывно ускоряя окисление. При достаточной скорости подвода кислорода это будет приводить к воспламенению (Мg, в экстремальных условиях - Nb, Ti и некоторые другие металлы; 2) образованием летучих, легко сублимирующихся оксидов на Mo, W, V, Re, Os (и некоторых сплавах с их высоким содержанием), не дающих защитной окалины. При достаточной скорости подвода кислорода и температурах, обеспечивающих большую скорость сублимации оксида, эти металлы подвержены катастрофическому окислению; 3)образованием на поверхности легкоплавких оксидов (эвтектик). На сталях, в т.ч. нержавеющих, наблюдаются высокие скорости окисления при сжигании мазута или нефти с высоким содержанием соединений V - “ванадиевая коррозия”. Причиной катастрофического окисления является осаждение на поверхности золы, содержащей V2О5, которая образует легкоплавкую эвтектику (tпл.V2O5=6900C) и может растворять оксидные пленки Fe, Ni и Сr с образованием ванадатов: Fe2O3 + V2O5 = 2FeVO4, и далее окисляет железо: 4Fe + 3V2O5= 2Fe2O3+3V2O3.
Дата добавления: 2017-02-13; просмотров: 2491;











