I.2.3 ПЕРВЫЙ ЗАКОН (НАЧАЛО) ТЕРМОДИНАМИКИ. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ
Внутреннюю энергию идеального газа можно определить с помощью первого закона термодинамики.
Изменение внутренней энергии 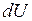 тела (системы) при переходе из одного состояния в другое равно сумме совершенной над телом работы
тела (системы) при переходе из одного состояния в другое равно сумме совершенной над телом работы 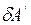 и полученного им количества теплоты
и полученного им количества теплоты 
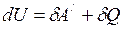 . (I.63)
. (I.63)
В этой формулировке первого закона термодинамики учитывается, что существуют две формы передачи энергии – работа и теплота.
Если работу 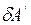 , совершенную над телом (системой) внешними силами, заменить равной ей численно, но противоположной по знаку работой
, совершенную над телом (системой) внешними силами, заменить равной ей численно, но противоположной по знаку работой 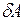 , совершенной самим телом (системой) над внешними телами, то
, совершенной самим телом (системой) над внешними телами, то
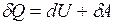 . (I.64)
. (I.64)
Количество теплоты  , которое получено телом (системой), расходуется на изменение внутренней энергии
, которое получено телом (системой), расходуется на изменение внутренней энергии 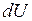 и на работу
и на работу 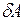 системы (тела) против внешних сил(другая формулировка первого закона термодинамики).
системы (тела) против внешних сил(другая формулировка первого закона термодинамики).
Первый закон термодинамики применительно к изотермическому процессу в идеальном газе имеет вид
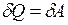 .
.
Внутренняя энергия идеального газа при этом изменяться не будет, так как 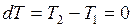 и
и 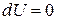 . Всё подведённое количество теплоты расходуется на работу против внешнего давления.
. Всё подведённое количество теплоты расходуется на работу против внешнего давления.
При изохорном процессе количество теплоты идёт только на увеличение внутренней энергии газа,
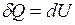 .
.
Следовательно, температура газа повышается на 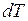 . Работу расширения газ не совершает
. Работу расширения газ не совершает 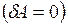 .
.
При изобарическом процессе количество теплоты, подводимое к газу, расходуется и на увеличение внутренней энергии и на работу расширения, которую совершает газ против внешнего давления
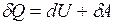 .
.
При адиабатическом процессе ( 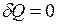 ) первый закон термодинамики принимает вид
) первый закон термодинамики принимает вид
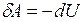 .
.
В условиях отсутствия теплообмена с внешней средой работа, которую производит тело против внешних сил, происходит за счёт убыли его внутренней энергии. Например, если идеальный газ адиабатически расширяется, преодолевая внешнее давление, то работа расширения газа сопровождается убылью его внутренней энергии и охлаждением.
Для равновесного адиабатического процесса справедливо уравнение Пуассона
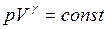 . (I.65)
. (I.65)
Диаграмма адиабатического процесса (адиабата) в координатах 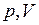 изображена сплошной линией (гиперболой) и сравнивается с пунктирной изотермой (рис. 9).
изображена сплошной линией (гиперболой) и сравнивается с пунктирной изотермой (рис. 9).
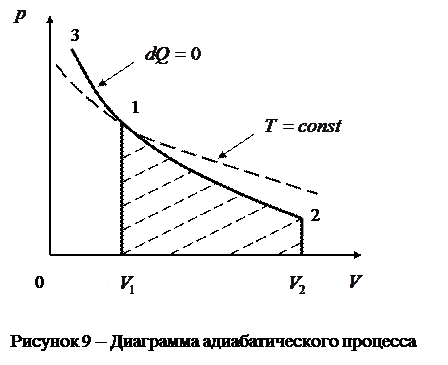 |
Из рисунка видно, что адиабата идёт более круто, чем изотерма. Это объясняется тем, что при адиабатическом сжатии (1–3), увеличение давления газа обусловлено не только уменьшением его объёма, как при изотермическом сжатии, но и повышением температуры.
Работа, совершаемая газом при адиабатическом расширении (1–2) (определяется площадью, заштрихованной фигуры на рис.9), меньше, чем при изотермическом расширении. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом расширении – температура поддерживается постоянной за счёт притока извне эквивалентного количества теплоты.
Сводные данные о характеристиках изопроцессов в газах содержатся в приложении А., таблица А.1.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность – они происходят при постоянной теплоёмкости. В первых двух процессах теплоёмкости соответственно равны 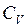 и
и 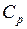 , в изотермическом процессе
, в изотермическом процессе 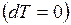 теплоёмкость
теплоёмкость 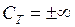 , в адиабатическом теплоёмкость равна нулю. Процесс, в котором теплоёмкость остаётся постоянной, называется политропным.
, в адиабатическом теплоёмкость равна нулю. Процесс, в котором теплоёмкость остаётся постоянной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоёмкости 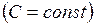 можно вывести уравнение политропы:
можно вывести уравнение политропы:
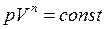 , (I.66)
, (I.66)
где 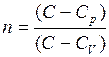 - показатель политропы.
- показатель политропы.
Дата добавления: 2016-09-06; просмотров: 3746;











