I.1.6 ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ
Кинетическая теория газов представляет собой учение о строении и физических свойствах газов, основанное на статистическом методе исследования.
Основное уравнение кинетической теории газов устанавливает зависимость между давлением газа 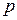 , его объёмом
, его объёмом 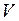 и кинетической энергией поступательного движения его молекул
и кинетической энергией поступательного движения его молекул 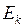
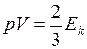 , (I.16)
, (I.16)
Суммарная кинетическая энергия поступательного движения N молекул газа, находящихся в сосуде, равна
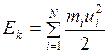 . (I.17)
. (I.17)
Для однородного газа 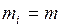 0 (массы всех молекул одинаковы), но скорости
0 (массы всех молекул одинаковы), но скорости 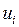 различны и
различны и
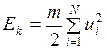 . (I.18)
. (I.18)
Введём среднюю квадратичную скорость 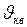 поступательного движения молекул газа
поступательного движения молекул газа
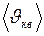
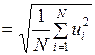 , (I.19)
, (I.19)
где 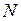 – общее число молекул в объёме
– общее число молекул в объёме 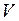 . Средняя квадратичная скорость характеризует всю совокупность молекул и имеет смысл применительно к одной молекуле или небольшому числу молекул. Выражение для
. Средняя квадратичная скорость характеризует всю совокупность молекул и имеет смысл применительно к одной молекуле или небольшому числу молекул. Выражение для 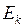 при введении
при введении 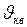 имеет вид
имеет вид
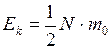
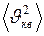 (I.20)
(I.20)
Выразим 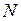 через концентрацию
через концентрацию 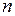 газа
газа
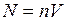 . (I.21)
. (I.21)
Подставив уравнения (I.20) и (I.21), в уравнение (I.16) и учитывая, что в 3-х мерном пространстве давление на стенку сосуда осуществляется лишь скоростями или проекциями скоростей в одном направлении, перпендикулярном стенке, получим основное уравнение молекулярно-кинетической теории идеальных газов
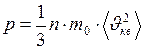 , (I.22)
, (I.22)
где m0 – масса одной молекулы.
Средняя квадратичная скорость движения молекул может быть определена по температуре газа. Сравнивая (1.22) с выражением (1.13) и (1.14) и учитывая (1.21), 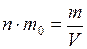 и
и 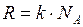 , получим
, получим
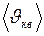
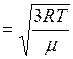 ; (I.23)
; (I.23)
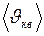
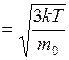 , (I.24)
, (I.24)
где 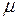 – молярная масса газа, её можно определить по таблице Д.И. Менделеева, или вычислить по формуле
– молярная масса газа, её можно определить по таблице Д.И. Менделеева, или вычислить по формуле 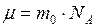 ;
; 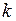 - постоянная Больцмана.
- постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекулы идеального газа
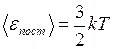 . (I.25)
. (I.25)
Таким образом, термодинамическая температура есть величина, пропорциональная средней энергии поступательного движения молекул.
Заметим, что лишь одноатомные молекулы имеют только поступательное движение, а уравнение (1.24) как раз и описывает этот случай. Двух – и многоатомные молекулы, кроме поступательного, могут совершать также вращательное и колебательное движения. Эти виды движения связаны с некоторым запасом энергии, вычислить который позволяет устанавливаемый классической статистической физикой закон равномерного распределения энергии по степеням свободы.
Числом степеней свободы тела называется наименьшее число координат (число независимых координат), которые нужно задать для того, чтобы полностью определить положение тела в пространстве.
Закон равномерного распределения энергии по степеням свободы:на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная 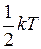 .
.
Из данного закона вытекает, что средняя энергия молекулы определяется по формуле

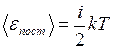 ,(I.26)
,(I.26)
где 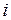 – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы
– сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы
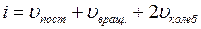 . (I.27)
. (I.27)
Закон равномерного распределения энергии по степеням свободы приводит к выводу о равноправности всех степеней свободы молекулы – все они вносят одинаковый вклад в её среднюю энергию. Этот вывод имеет ограниченную область применимости и пересмотрен в квантовой статистике.
Исключение: СО2 имеет столько же степеней свободы, как и двухатомный газ, т.к. имеет линейную структуру.
Ниже приведена таблица 1, по определению числа степеней свободы.
Таблица 1 – Число степеней свободы
| Газ | Поступательное движение | Вращательное движение | Колебательное движение | Всего |
| Одноатомный | – | – | ||
| Двухатомный | – | |||
| Многоатомный | – |
Дата добавления: 2016-09-06; просмотров: 3479;











