Линейный закон окисления металлов
При окислении металлов могут протекать процессы, не приводящие к образованию сплошной оксидной пленки. В этом случае процесс роста пористой несплошной оксидной пленки характеризуется последовательно протекающими стадиями:
1) перенос окислителя (например, кислорода) к поверхности раздела фаз “металл – газ”;
2) адсорбции окислителя на поверхности металла: М(т)+О2(г)=М(т)|2О(адс);
3) ионизации адсорбированных атомов окислителя: О + 2е = О2-;
3) реакции образования окисла: mM(T) + 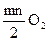 (адс) = mMn+ +
(адс) = mMn+ + 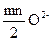 = МmOmn/2(T);
= МmOmn/2(T);
4) при образовании летучего или возгоняющегося оксида – отвод продуктов коррозии.
Оксидные пленки, не образующие сплошного плотного слоя (при 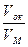 <1) не являются защитными (слабозащитными), так как окислитель может проникать к поверхности металла адсорбироваться на ней и вступать с металлом в химическую реакцию.
<1) не являются защитными (слабозащитными), так как окислитель может проникать к поверхности металла адсорбироваться на ней и вступать с металлом в химическую реакцию.
Схема роста таких пленок представлена на рис. 2.4. При образовании первичной пленки на поверхности металла возникает тончайший сплошной слой псевдоморфного оксида, являющегося своеобразным кристаллографическим продолжением решетки металла, в котором отсутствуют напряжения вследствие изменения параметров решетки оксида (рис.2.4, а). При достижении некоторой критической толщины внутренние напряжения в оксиде реализуются и приводят к превращению в обычный оксид с соответствующими параметрами решетки и плотности оксида (рис.2.4, b). По этой схеме оксидный слой состоит из тонкого внутреннего псевдоморфного слоя, несколько тормозящего диффузию реагентов и, соответственно, рост пленки и внешнего утолщающегося несплошного слоя, который не может тормозить диффузию металла и окислителя (рис.2.4, 1, b). Поскольку толщина этого слоя постоянна, то она и определяет постоянную скорость окисления.
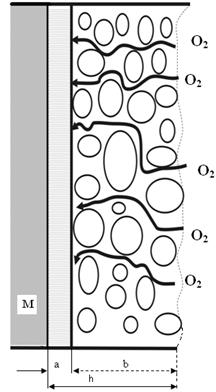
1 3
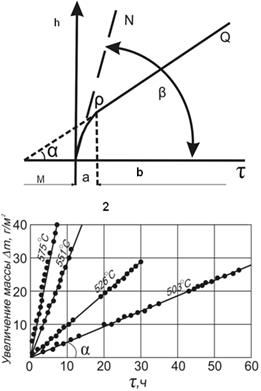
Рис.2.4. Схема процесса образования пористой оксидной пленки (1) с общей толщиной h: а - тонкий, сплошной слой оксида неизменной толщины, b - пористый незащитный, растущий при окислении металла слой; 2 – схема линейного закона окисления металлов; 3 – окисление Mg в кислороде при различных температурах.
После достижения некоторой критической толщины псевдоморфной пленки, а, (рис.2.4.2) процесс окисления носит линейный характер. Тангенс угла β касательной МN при τ = 0 характеризует константу скорости химической реакции, т.е. максимальную скорость окисления. Установившаяся постоянная скорость роста оксидной пленки характеризуется tg угла α наклона прямой PQ.
В этом случае скорость окисления может быть выражена уравнением:
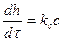 , (2.14)
, (2.14)
где h – толщина пленки, t – время окисления, kс – константа скорости химической реакции, с – концентрация окислителя на поверхности металла (не зависящая от τ).
Разделив переменные и интегрируя (2.11): 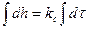 , получаем уравнение прямой, представляющее линейный закон роста пленки:
, получаем уравнение прямой, представляющее линейный закон роста пленки:
h = kcτ + const = k1τ +C1, (2.15)
где k1 = tg α (по рис. 2.2. 2), C1 = h при t = 0 (толщина пленки до окисления).
В большинстве случаев C1 ≈ 0, и линейный закон роста преобразуется:
h = k1τ (2.16)
При линейном законе окисления контролирующей стадией может быть процесс: а) протекающий на границе раздела фаз; б) переноса молекул окислителя к металлу через газовый слой у поверхности; в) диффузии и миграции реагирующих компонентов через постоянный по толщине защитный слой продуктов взаимодействия металлов с окислителем, на поверхности которого растет пористый слой окисной пленки.
В большинстве случаев рост пористой незащитной пленки контролируется скоростью химической реакции (кинетический контроль процесса) и протекает по линейному закону во времени. По линейному закону окисляются не удовлетворяющие условию сплошности щелочные и щелочноземельные металлы, Mg (рис.2.4, 3), скорость окисления которых настолько велика, что приводит к самовозгоранию, а также металлы, образующие летучие или частично возгоняющиеся оксиды (W, Mo и их сплавы).
Дата добавления: 2017-02-13; просмотров: 3395;











