Влияние температуры
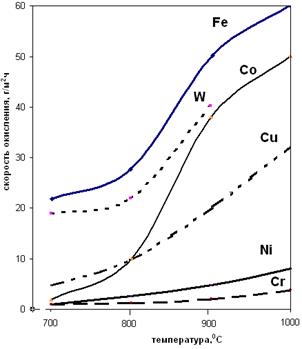
Температура существенно влияет на процесс окисления металлов. С повышением температуры скорость окисления возрастает, несмотря на уменьшение термодинамической возможности процесса. Влияние температуры на скорость окисления металлов приведена на рис. 2.10, а.
Влияние температуры на скорость окисления определяется зависимостью константы скорости химической реакции (Кс) при кинетическом контроле процесса, или коэффициента диффузии реагентов окисления (D) при диффузионном контроле процесса, которое определяется экспоненциальным законом, – уравнением Аррениуса:
Кс=К0с 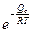 , (2.40)
, (2.40)
D=D0 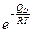 , (2.41)
, (2.41)
где К0с и D0 – константы, формально равные скорости химической реакции и коэффициенту диффузии при Т→ 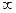 соответственно; Qc и QD – кажущаяся энергия активации химической реакции и эффективная энергия активации диффузии [Дж/моль]; R=8,314Дж/(моль.К) – универсальная газовая постоянная; Т – температура, 0К.
соответственно; Qc и QD – кажущаяся энергия активации химической реакции и эффективная энергия активации диффузии [Дж/моль]; R=8,314Дж/(моль.К) – универсальная газовая постоянная; Т – температура, 0К.
Для определения энергии активации уравнение (2.40) логарифмируют:
lnKc= lnK0c - 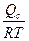 или lgKc= lgK0c -
или lgKc= lgK0c - 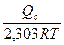 , (2.42)
, (2.42)
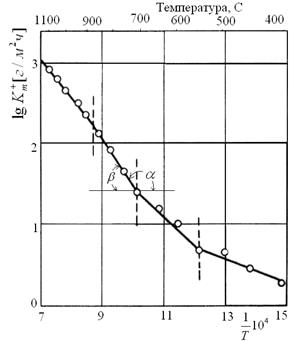
и по построенному в координатах lgKc = f(1/T) графику (рис.2.10, б) определяют энергию активации 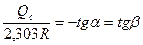 , lgK0c = lgKc при 1/Т=0.
, lgK0c = lgKc при 1/Т=0.
Величина кажущейся энергии активации Qc, определенная выше, для гетерогенных химических реакций меньше истинной энергии активации, Q, на величину теплоты адсорбции реагирующего вещества, λ: Qc=Q - λ.
а б
Рис.2.10. Зависимость скорости окисления металлов в кислороде (а), и константы скорости окисления железа от температуры в логарифмических координатах (б).
Если при изменении температуры изменяется структура металла или механизм процесса окисления, константа скорости окисления описывается ломаной линией (рис.2.10,б) и имеет разные величины при различных температурах. С учетом этого, расчет энергии активации и коэффициентов К0с и D0 дает возможность расчета глубины коррозионных поражений подстановкой этих значений в уравнения 2.16, 2.23, 2.25, 2.28, 2.37, 2.38.
Влияние давления
Уменьшение парциального давления окислителя ниже равновесного давления диссоциации образующегося оксида (для кислорода 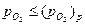 ) приводит металл в термодинамически устойчивое состояние и его окисление прекращается. Если парциальное давление окислителя больше равновесного давления, его влияние может быть различным. В отсутствие защитной пленки, если скорость окисления, определяется скоростью химической реакции взаимодействия окислителя с поверхностью металла (например, Ni + ½ S2 = NiS), скорость окисления пропорциональна
) приводит металл в термодинамически устойчивое состояние и его окисление прекращается. Если парциальное давление окислителя больше равновесного давления, его влияние может быть различным. В отсутствие защитной пленки, если скорость окисления, определяется скоростью химической реакции взаимодействия окислителя с поверхностью металла (например, Ni + ½ S2 = NiS), скорость окисления пропорциональна 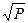 окисляющего газа. В остальных случаях изменение давления неоднозначно влияет на скорость окисления, что зависит от концентрации и распределения точечных дефектов в окисной пленке.
окисляющего газа. В остальных случаях изменение давления неоднозначно влияет на скорость окисления, что зависит от концентрации и распределения точечных дефектов в окисной пленке.
У металлов, на поверхности которых растет окисная полупроводниковая пленка n-типа, повышение 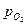 уменьшает концентрацию точечных дефектов на границе пленка – газ, не изменяя их концентрацию на границе пленка – металл, что практически не влияет на скорость диффузии точечных дефектов, и, соответственно, скорость роста пленки. Для пленок с р – проводимостью концентрация точечных дефектов возрастает с увеличением давления и максимальна на границе пленка – газ, что ускоряет рост пленки.
уменьшает концентрацию точечных дефектов на границе пленка – газ, не изменяя их концентрацию на границе пленка – металл, что практически не влияет на скорость диффузии точечных дефектов, и, соответственно, скорость роста пленки. Для пленок с р – проводимостью концентрация точечных дефектов возрастает с увеличением давления и максимальна на границе пленка – газ, что ускоряет рост пленки.
Если с изменением парциального давления окислителя контролирующая стадия процесса изменяется, например, механизм процесса окисления определяется не диффузией окислителя, а миграцией ионов под действием электрического поля, или при росте пленки на поверхности твердого раствора в металлической основе (металлы подгруппы титана), то, независимо от типа проводимости пленки, повышение парциального давления окислителя увеличивает скорость окисления (рис. 2.11, а).
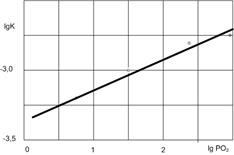
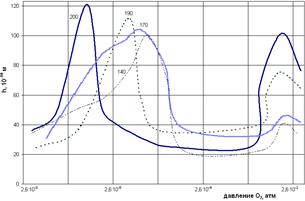 а б
а б
Рис.2.11. Влияние давления кислорода на константу скорости окисления Тi при 10000С (а), и толщину оксидной пленки на Cu при различных температурах, 0С (б).
Неоднозначное влияние парциального давления кислорода на скорость газовой коррозии проявляется в проявлении высокотемпературной пассивации, при которой скорость окисления в определенном интервале давлений остается очень низкой, что обусловлено образованием более совершенной оксидной пленки. Высокотемпературная пассивация наблюдается на Cu (рис. 2.11, б), Ti, Zr, нержавеющих хромистых и хромоникелевых сталях и может быть использована для “выращивания” высокозащитной пленки с целью повышения жаропрочности.
Дата добавления: 2017-02-13; просмотров: 3618;











