Ионно-электронная модель высокотемпературного окисления
Процесс роста оксидных пленок не ограничивается перемещением ионов по механизму диффузии вследствие градиента концентраций. Оксидные слои на металле являются ионными кристаллами, в кристаллической решетке которых под действием электрического поля происходит перемещение ионов и электронов с соответствующим типом проводимости, причем сумма чисел переноса катионов, анионов и электронов, tк+tа+tэ=1. Определяемые экспериментально соотношения чисел переноса позволяют определить преобладающий характер проводимости. Так, преимущественно катионная проводимость характерна для: AgCI, AgBr , АgJ , AgNО3, NaCl и других щелочно-галоидных солей (<500 °С); анионная - PbF2, РbС12, РbВг2, BaF3, ВаС12, ВаВг2 (200-500°С); смешанная катионно-анионная - NaCI и другие щелочно-галоидные соли около температур плавления (>500°С), РbJ2 (250°С); электронная проводимость характерна для металлов, Fe3O4, PbS; смешанная ионно-электронная проводимость - AgS, AgSe, NiO, FeS, смешанная ионно-электронная с преобладанием катионной - CuJ, Cu2O, FeO, с преобладанием электронной проводимости – ZnO.
По ионно-электронной модели Вагнера рост оксидной пленки обусловлен работой гальванического элемента (рис.2.5): анод – поверхность металла на границе с пленкой, отдает катионы металла и электроны, катод – поверхность пленки на границе с окислителем, где ассимилируются электроны окислителем (кислородом) и образуются ионы О2-. По этой схеме скорость процесса окисления определяется током гальванического элемента по законам Фарадея: 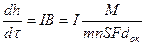 , (2.29)
, (2.29)
где I – величина тока, В – коэффициент перехода от массы к толщине пленки оксида МmOn, М и dок– молекулярная масса и плотность оксида, m – число атомов металла в оксиде, n – валентность металла, h – толщина пленки оксида площадью S, F –число Фарадея (96500 Кл/г-экв или 26,8 А.ч/г-экв).
В таком концентрационном гальваническом элементе максимальная ЭДС обусловлена изменением энергии Гиббса в соответствии с уравнениями 2.2 и 2.7:
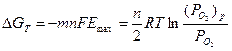 , (2.30)
, (2.30)
а общее сопротивление оксидной пленки R с удельной электропроводностью χ:
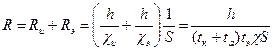 , (2.31)
, (2.31)
где Rи и Rэ – ионное и электронное сопротивление; χ – общая удельная электропроводность пленки [Ом-1см-1] толщиной h [см] площадью S [см2]; χи = (tк + tа). χ – парциальная удельная электропроводность ионов; χэ= tэ. χ – парциальная удельная проводимость электронов в пленке; (tк + tа + tэ) =1 - числа переноса катионов, анионов и электронов.
На основе (2.30-2.31) и закона Ома (без учета поляризации) получаем уравнение: 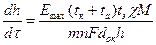 , (2.32)
, (2.32)
интегрируя которое, получаем параболическое уравнение для скорости роста пленки:
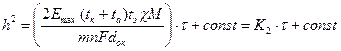 , (2.33)
, (2.33)
где К2 – константа скорости окисления.
 Ионно-электронная модель дает тот же параболический закон окисления, что и диффузионный механизм и позволяет рассчитать скорость газовой коррозии по известным физико-химическим свойствам образующихся продуктов. Из уравнения 2.33 следует, что К2 увеличивается с ростом энергии Гиббса и ЭДС элемента Емах, при отсутствии химического сродства металла к кислороду (Емах=0), окисления не происходит. К2 возрастает с увеличением удельной электропроводности пленки, χ, что совпадает с данными по скорости окисления металлов (табл. 2.1) и определяется соотношениями
Ионно-электронная модель дает тот же параболический закон окисления, что и диффузионный механизм и позволяет рассчитать скорость газовой коррозии по известным физико-химическим свойствам образующихся продуктов. Из уравнения 2.33 следует, что К2 увеличивается с ростом энергии Гиббса и ЭДС элемента Емах, при отсутствии химического сродства металла к кислороду (Емах=0), окисления не происходит. К2 возрастает с увеличением удельной электропроводности пленки, χ, что совпадает с данными по скорости окисления металлов (табл. 2.1) и определяется соотношениями
Таблица 2.1
Удельная электропроводность оксидов [Ом-1см-1] при 7270К
| BeO | Al2O3 | SiO2 | NiO | Cr2O3 | CoO | Cu2O | FeO |
| 10-9 | 10-7 | 10-6 | 10-2 | 10-1 | 102 |
между ионной и электронной проводимостями. Т.е. К2 будет уменьшаться как при очень небольшой электронной проводимости, так и при отсутствии ионной проводимости. Максимальная скорость окисления наблюдается при t э= tк + tа.
Дата добавления: 2017-02-13; просмотров: 2031;











