Свойства атома галогена в боковой цепи
Если галоген находится в боковой цепи бензольного ядра, то он легко вступает в обычные реакции нуклеофильного замещения. Например, хлористый бензил легко гидролизуется водным раствором Na2CO3, реагирует с третичными аминами и так далее.
 Подвижность галогена в молекулах таких арилгалогенидов объясняется особой устойчивостью катиона, возникающего при отщеплении аниона галогена, вследствие р-π –сопряжения:
Подвижность галогена в молекулах таких арилгалогенидов объясняется особой устойчивостью катиона, возникающего при отщеплении аниона галогена, вследствие р-π –сопряжения:

 СН2- Сl СН2+
СН2- Сl СН2+
 |  |

 + Cl–
+ Cl–
бензил хлористый бензил-катион
В образующемся бензил-катионе в р-π –сопряжении участвуют 7 р-орбиталей атомов углерода (6 р-орбиталей бензольных углеродных атомов и 1 р-орбиталь карбокатиона боковой цепи). Чем больше р-орбиталей участвует в сопряжении, тем устойчивее промежуточное соединение, которое образовалось при отщеплении аниона хлора.
Электронодонорные заместители в бензольном кольце увеличивают подвижность атома галогена в боковой цепи, поскольку образуется более устойчивый промежуточный карбокатион при отщеплении галогена; электроноакцепторные заместители кольца уменьшают устойчивость получающегося карбокатиона:
 | 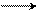 |

 СН2+ CH2+
СН2+ CH2+
 |  |

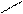
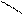

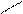 >
>
 |  |  | |||
СН3 NO2
п-метилбензильный катион п-нитробензильный катион
В случае п-метилбензильного катиона электронные эффекты заместителя (СН3) (положительный индуктивный и положительный мезомерный (σ-π-сопржение) эффекты) направлены в одну сторону, усиливая друг друга, и в большей степени гасят положительный заряд на карбокатионе.
В случае п-нитробензильного катиона электронные эффекты заместителя (NO2) (отрицательный индуктивный и отрицательный мезомерный (π- π-сопряжение) эффекты) направлены в противоположные стороны, то есть происходит «рассеивание» эффектов, и положительный заряд карбокатиона гасится в меньшей степени. Поэтому устойчивость первого карбокатиона больше, чем второго, а именно, чем нейтральнее частица, тем она устойчивее.
Примером легкости течения реакции замещения галогена, находящегося в боковой цепи, служит гидролиз хлористого бензила в спиртовом растворе, протекающим по механизму SN1:
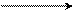 С6Н5 – СН2 – Cl + H2O C6H5 – CH2 – OH + HCl
С6Н5 – СН2 – Cl + H2O C6H5 – CH2 – OH + HCl
хлористый бензил бензиловый спирт
Первая стадия – медленная, представляет собой электролитическую диссоциацию хлористого бензила с образованием карбокатиона:
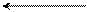
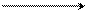
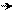 C6H5 – CH2δ+ Clδ– C6H5 – CH2+ + Cl–
C6H5 – CH2δ+ Clδ– C6H5 – CH2+ + Cl–
Вторая стадия – быстрая, представляет собой взаимодействие карбокатиона с нуклеофилом:
 C6H5 – CH2+ + Н2О С6Н5 – СН2 – ОН + Н+
C6H5 – CH2+ + Н2О С6Н5 – СН2 – ОН + Н+
бензиловый спирт
Дата добавления: 2017-01-16; просмотров: 2886;











