Химические свойства арилгалогенидов
1) Реакция Вюрца – Фиттига (взаимодействие арилгалогенидов с галогеноалканами на поверхности металлического натрия)
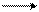 C6H5Br + С2H5Br + 2Na C6H5 – C2H5 + 2NaBr
C6H5Br + С2H5Br + 2Na C6H5 – C2H5 + 2NaBr
бромбензол бромэтан этилбензол
Механизм реакции:
Na Na
 C6H5Br C6H5• C6H5Na
C6H5Br C6H5• C6H5Na
–NaBr фенилнатрий
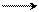 C6H5Na + C2H5Br C6H5 – C2H5 + NaBr
C6H5Na + C2H5Br C6H5 – C2H5 + NaBr
Побочная реакция:
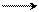 C6H5Na + C6H5Br С6H5 – C6H5 + NaBr
C6H5Na + C6H5Br С6H5 – C6H5 + NaBr
дифенил (фенилбензол)
2)Нуклеофильное замещение атома галогена в ароматическом ядре- SN
a)Реакции нуклеофильного замещения в незамещенных галогеноарилах
или реакция – кинезамещение, механизм SN(E – A)
В отличие от галогеноалкилов простые незамещенные галогеноарилы являются нереакционноспособными веществами по отношению к нуклеофильным реагентам. Они не реагируют ни с NaOH, ни с солями серебра, ни с цианидами металлов, ни с аммиаком и его производными в тех условиях, в которых протекают реакции замещения с галогеноалкилами. Подобная инертность связана с двойственной природой атома галогена у арилгалогенидов и винильных галогенопроизводных.
Хлор- и бромбензолы реагируют с едкими щелочами только при 3000С или при более низких температурах в присутствии катализаторов. Реакция замещения галогенов в ароматическом ядре отличается от замещения в алифатическом ряду.
Реакция идет в 2 ступени: на первой ступени (медленная стадия) происходит отщепление или элиминирование (Е) галогеноводорода с образованием очень реакционноспособного промежуточного соединения бензина или дегидробензола,а на 2-ой ступени (быстрая стадия) происходит присоединение (А) нуклеофильных реагентов:

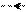
 +OH2 OH
+OH2 OH


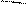
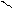




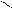






 Br H2O׃ H
Br H2O׃ H
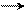

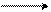

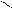










 H (E)
H (E)
(A)


 –HBr фенол
–HBr фенол
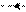

 +NH3 NH2
+NH3 NH2



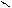

 дегидробензол׃NH3 H
дегидробензол׃NH3 H


 (бензин)
(бензин)
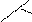 | |||||
 |  | ||||
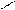



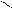 анилин
анилин

Промежуточное соединение содержит тройную связь, природа которой не идентична с таковой у ацетиленовых углеводородов. При отщеплении галогеноводорода образующиеся р-орбитали, свободные от атомов водорода и галогена, находятся в той же плоскости, что и само кольцо и не способны к сопряжению с другими р-орбиталями ароматической связи, которые находятся перпендикулярно к плоскости кольца. Поэтому перекрывание между образующимися орбиталями небольшое, вследствие чего эта связь очень реакционноспособная и легко разрывается под действием нуклеофильных реагентов.
Доказательством такого механизма является тот факт, что входящая группа не всегда занимает положение, которое освобождает атом галогена.
Например, гидролиз п-хлортолуола дает эквимолярную смесь м- и п-крезолов:


 CH3 CH3 CH3
CH3 CH3 CH3
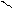
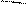







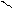
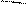 2NaOH [H2O]
2NaOH [H2O]
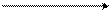
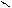 2 3400C + + 2NaCl,
2 3400C + + 2NaCl,


 OH
OH
Сl OH
п-хлортолуол п-крезол (50%) м-крезол (50%)
(п-окситолуол) (м-окситолуол)
а при аминированиио-хлоранизола образуется исключительно м-аминоанизол:

 OCH3 OCH3
OCH3 OCH3

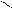




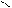
 Cl NaNH2[NH3]
Cl NaNH2[NH3]

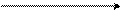 –330C + NaCl
–330C + NaCl

NH2
о-хлоранизол м-аминоанизол
(о-хлорметоксибензол) (м-аминометоксибензол)
При аминировании меченого атома углерода 14С хлорбензола образуется равное количество меченых в 1-ом и 2-ом положениях анилинов:




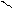
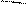


 Cl NH2
Cl NH2








 * 1 *1 * 1 *1 NH2
* 1 *1 * 1 *1 NH2



 2 NaNH2[NH3] 2 NH3 2 2
2 NaNH2[NH3] 2 NH3 2 2
 –330C +
–330C +
–NaCl

 хлорбензол анилин
хлорбензол анилин
Такие перегруппировки объясняются возможностью присоединения нуклеофильных реагентов к дегидробензолу по тройной связи в двух направлениях.
Другой пример, нуклеофильное замещение атома хлора гидроксогруппой в молекуле о-хлортолуола. Образующийся промежуточный продукт с тройной связью (метилдегидробензол) присоединяет молекулу воды в двух направлениях, а именно, гидроксогруппа встает на место либо ушедшего атома хлора, либо рядом по месту нахождения тройной связи в кольце, образующейся при отщеплении галогеноводорода:







 CH3 CH3 CH3 CH3
CH3 CH3 CH3 CH3




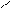


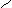

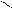

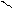
 Cl OH
Cl OH


 2 2H2O +
2 2H2O +

 –2HCl
–2HCl

 H OH
H OH
о-хлортолуол метилдегидробензол о-окситолуол м-окситолуол
Дата добавления: 2017-01-16; просмотров: 2728;











