Сравнение реакционной способности в реакциях нуклеофильного замещения алкилгалогенидов, хлористого бензила, хлористого аллила, хлористого винила и хлорбензола
Для сравнения реакционной способности в реакциях нуклеофильного замещения галогеноалканов, хлористого бензила, хлористого аллила, хлористого винила и хлорбензола рассматривается подвижность атома галогена, в частности, атома хлора в указанных примерах.
Рассмотрим электронные эффекты, которые присущи молекулам в целом и катионам, которые образуются в результате отщепления атома галогена.
Из указанных соединений двойственной природой обладают атомы хлора в молекулах хлористого винила и хлорбензола.
 δ+
δ+


 δ– СН2 = СНδ+ Cl׃δ – – CH2 – CH = Cl + δ – CH2 – CH – Clδ+
δ– СН2 = СНδ+ Cl׃δ – – CH2 – CH = Cl + δ – CH2 – CH – Clδ+
хлористый винил
В молекуле хлористого винила атом хлора обладает сильным отрицательным индуктивным эффектом, в результате чего атом хлора приобретает частично отрицательный заряд, а соседний углеродный атом частично положительный заряд, то есть индуктивный эффект способствует отрыву атома хлора от углеродного атома. Но наряду с индуктивным эффектом одновременно в молекуле действует мезомерный эффект в виде р-π-сопряжения, который в силу выравнивания π-электронной плотности действует в противоположном индуктивному эффекту направлении. В результате атом хлора приобретает частично положительный заряд и как бы двоесвязывается с углеродным скелетом. Отсюда, атом хлора в молекуле хлористого винила мало подвижен, и чтобы его оторвать от атома углерода потребуются жесткие условия (например, повышенная температура, присутствие катализатора).





 δ– δ+
δ– δ+

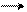

 δ+ δ+ Cl׃δ– Cl+
δ+ δ+ Cl׃δ– Cl+
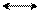 δ– δ–
δ– δ–
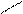 δ+
δ+
хлорбензол
В молекуле хлорбензола действуют одновременно те же эффекты, что и в молекуле хлористого винила, только в мезомерном эффекте в виде р-π-сопряжения у хлорбензола участвуют уже 7 р-орбиталей по сравнению с хлористым винилом, где в р-π-сопряжении участвуют только 3-р-орбитали. То есть в устойчивости всей молекулы у хлорбензола принимают участие большее количество р-орбиталей, чем у хлористого винила.












 • • •• • • ••
• • •• • • ••












 СН2 = СН – Сl • • Cl
СН2 = СН – Сl • • Cl








 • •
• •



хлористый винил хлорбензол
Отсюда, атом хлора в молекуле хлорбензола менее подвижен, чем в молекуле хлористого винила.
Галогеноалканы, галогеноаллилы и галогенобензилы обладают очень подвижным атомом галогена вследствие того, что в молекуле действует только один электронный эффект, а именно, отрицательный индуктивный, который способствует отрыву атома галогена от углеродного скелета:
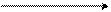
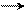 CH3 – CH2δ+ Cl δ– CH3 – CH2+ + Cl –
CH3 – CH2δ+ Cl δ– CH3 – CH2+ + Cl –
хлористый этил этил-катион
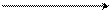
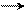 CH2 = CH – CH2δ+ Cl δ– CH2 = CH – CH2+ + Cl –
CH2 = CH – CH2δ+ Cl δ– CH2 = CH – CH2+ + Cl –
хлористый аллил аллил-катион


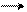 СH2δ+ Cl δ– СH2+
СH2δ+ Cl δ– СH2+
 |  |


 + Cl –
+ Cl –
хлористый бензил бензил-катион
Образующиеся карбокатионы обладают разной устойчивостью. Чем нейтральнее полученная частица, тем она устойчивее, следовательно, в том случае, где более устойчив карбокатион, там легко оторвался атом хлора, то есть этот атом хлора более подвижен.
Рассмотрим устойчивость образующихся карбокатионов.
В этил-катионе на устойчивость карбокатиона действует положительный индуктивный эффект СН3-группы и сопряжение карбокатиона с тремя β- С-Н-связями метильной группы (сопряжение действует по σ-связи):
 Н
Н
 β Частица мало устойчива.
β Частица мало устойчива.

 Н β С СН2+
Н β С СН2+
β
Н
В аллил-каионе на устойчивость карбокатиона действует уже мезомерный эффект в виде р-π-сопряжения, который, как известно, более сильный, чем индуктивный эффект. В устойчивости аллил-катиона участвуют 3 р-орбитали:
 |  |  |
 • • +
• • +
 δ+СН2 = СН – СН2+ СН2 = СН – СН2
δ+СН2 = СН – СН2+ СН2 = СН – СН2

аллильный катион
Следовательно, аллильный катион более устойчив, чем этил-катион.
В бензил-катионе на устойчивость карбокатиона действует мезомерный эффект в виде р-π-сопряжения, в котором участвуют 7 р-орбиталей:
 | |||
 | |||




 • • +
• • +



 • • СН2 СН2+
• • СН2 СН2+

• •
бензил-катион
Чем больше р-орбиталей участвует в сопряжении, тем более устойчивая образующаяся частица. Следовательно, бензильный катион более устойчив, чем аллильный катион.
Из выше изложенного можно сделать вывод, что по устойчивости катионов, а следовательно, и по подвижности атома хлора указанные соединения можно расположить в следующий ряд:
С6H5 – CH2 – Cl > CH2 = CH – CH2 – Cl > CH3 – CH2 – Cl > CH2 = CH – Cl > C6H5 – Cl
Такой вывод подтверждают экспериментальные данные по установлению длины связи С – Г в приведенных соединениях:
Соединение Длина связи С – Cl, нм
Хлористый этил (CH3 – CH2 – Cl) 0,177
Хлористый винил (CH2 = CH – Cl) 0,169
Хлористый аллил (CH2 = CH – CH2 – Cl) 0,178
Хлорбензол (C6H5 – Cl) 0, 139
Хлористый бензил (С6H5 – CH2 – Cl) 0,178
Дипольные моменты у хлорэтана – 2,0 D,
хлорвинила – 1.44 D,
хлорбензола – 1,56 D.
Уменьшение полярности связи С – Г снижает обменную способность атома галогена. Углерод, несущий галоген в ароматических и винильных системах, менее положителен и менее подвержен нуклеофильным атакам. Причина меньшей подвижности атома галогена в галогеновинилах и галогенобензолах заключается в сопряжении неподеленной электронной пары атома галогена с π-электронами двойной и ароматической связи, что упрочняет связь С – Г в хлористом виниле и хлорбензоле.
Наоборот, в галогеноаллилах, галогенобензилах и галогеноалкилах атом галогена очень подвижен, так как образующийся карбокатион имеет относительно большую устойчивость и стабилизируется сопряжением в виде разных электронных эффектов.
Дата добавления: 2017-01-16; просмотров: 9377;











