Максимальная работа реакции и ее связь с константой равновесия
Возможность протекания той или иной химической реакции, степень ее развития в данных физических условиях и полнота завершенности при достижении ею химического равновесия зависят от способности веществ взаимодействовать друг с другом.
Способность различных веществ взаимодействовать между собой с образованием новых соединений называется химическим сродством. Причинами, вызывающими химическое сродство, являются взаимодействия различного вида. Поскольку непосредственно измерить величину этих сил нельзя, о них судят по совершенной ими работе.
Наиболее полно отвечает требованиям, предъявляемым к критерию химического сродства, максимальная работа, то есть изменение изотермных потенциалов. По физическому смыслу максимальной работы реакции ее можно представить как величину той энергии, которую следует приложить к системе, чтобы остановить реакцию, то есть, чтобы преодолеть силы химического сродства.
Поскольку величина максимальной работы выражается изменением соответствующих изотермных потенциалов, она не зависит от пути, по которому протекает реакция, а лишь от свойств реагирующих веществ их начального и конечного состояний. Естественно, что в состоянии равновесия реакция не совершает полезной работы. Чем больше концентрации реагирующих веществ отличаются от равновесных и чем дальше от состояния равновесия находится данная реакция, тем большую работу она может совершить.
Величина максимальной работы реакции зависит от соотношения концентраций реагирующих веществ и определяет величину константы равновесия реакции.
Допустим, что реакция между газообразными веществами А, В, С, D протекает по уравнению
aA + bB = cC + dD + Q
В зависимости от начальной концентрации реагирующих веществ, температуры и давления эта реакция может протекать как в прямом, так и в обратном направлении.
Если все реагирующие вещества подчиняются закону идеального газа (PV = RT), то уменьшение изобарно-изотермного потенциала – G, которое наблюдается при протекании реакции до состояния химического равновесия, может быть выражена таким уравнением. (Без доказательства).
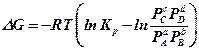 , где (10.1)
, где (10.1)
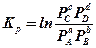 – константа равновесия, выраженная через равновесные парциальные давления
– константа равновесия, выраженная через равновесные парциальные давления
 – соотношение парциальных давлений, при которых газы вступили в реакцию, то есть начальные условия.
– соотношение парциальных давлений, при которых газы вступили в реакцию, то есть начальные условия.
Но так как согласно ранее изложенному 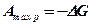 , то максимальная работа равна изменению изобарно-изотермного потенциала реагирующих веществ
, то максимальная работа равна изменению изобарно-изотермного потенциала реагирующих веществ
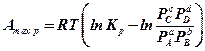 (10.2)
(10.2)
В зависимости от соотношений между Кр и  , реакция может развиваться в прямом или в обратном направлении. Выражение (10.2), связывающее максимальную работу реакции с константой равновесия и начальными парциальными давлениями реагирующих веществ, называется уравнением изотермы реакции или уравнением изотермы Вант-Гоффа. Согласно этому уравнению максимальная работа может достигать различных значений в зависимости от начальных и конечных парциальных давлений реагирующих веществ, поэтому для оценки химического сродства максимальную работу реакции нужно сравнивать при одинаковых начальных и конечных парциальных давлениях реагирующих веществ. Отсюда вытекает понятие нормального сродства.
, реакция может развиваться в прямом или в обратном направлении. Выражение (10.2), связывающее максимальную работу реакции с константой равновесия и начальными парциальными давлениями реагирующих веществ, называется уравнением изотермы реакции или уравнением изотермы Вант-Гоффа. Согласно этому уравнению максимальная работа может достигать различных значений в зависимости от начальных и конечных парциальных давлений реагирующих веществ, поэтому для оценки химического сродства максимальную работу реакции нужно сравнивать при одинаковых начальных и конечных парциальных давлениях реагирующих веществ. Отсюда вытекает понятие нормального сродства.
Уравнение нормального сродства реагирующих веществ можно записать, если положить парциальные давления всех веществ равными единице:
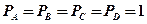 ат, тогда
ат, тогда
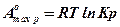 (10.3)
(10.3)
или при исходных концентрациях веществ
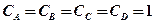 моль/л
моль/л
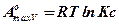 (10.4)
(10.4)
Следует иметь в виду, что расчеты по уравнениям изотермы реакции достаточно точны лишь для идеальных газов или идеальных растворов.
Уравнение изотермы реакции широко применяется в физической химии, так как оно позволяет дать количественную оценку химического средства веществ, а также судить о возможности протекания той или иной реакции. При этом если результат положительный, вещества могут взаимодействовать друг с другом, если отрицательный – не взаимодействуют. Если для заданных условий известны величины 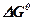 или
или 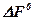 , из уравнения изотермы реакции можно определить также численные значения константы равновесия.
, из уравнения изотермы реакции можно определить также численные значения константы равновесия.
Контрольные вопросы:
1. Что называется гомогенной системой? Как можно выразить закон действующих масс применительно к этой системе?
2. Что такое гетерогенная система? Закон действующих масс для гетерогенной системы.
3. Проанализируйте уравнение изотермы реакции Вант-Гоффа. Что такое уравнение нормального сродства?
4. Какова зависимость константы равновесия реакции от давления?
5. Как зависим константа равновесия реакции от температуры?
Лекция 7 —Химическое равновесие в гомогенной и гетерогенной системе. Принцип Ле Шателье. Явления в жидких средах и на поверхности раздела фаз. О химическом сродстве элементов к кислороду.
Дата добавления: 2016-12-09; просмотров: 2971;











