Понятие о поверхностной энергии
Различные химические процессы, протекающие в гетерогенных системах, обычно начинают развиваться с поверхности раздела фаз, перемещаясь затем далее в глубь системы.
Условия существования молекул поверхностного слоя отличаются от тех, в которых находятся молекулы внутренних слоев. По этому свойства поверхности отличающихся от свойств внутренних слоев вещества. Особенности свойств поверхностных слоев вещества проявляются на любой поверхности раздела фаз, но особенно сильно – в системе и «жидкость – газ». Проявление этих свойств есть результат наличия на поверхности раздела фаз определенной энергии – поверхностной энергии, или энергии поверхностного натяжения. Под действием этой энергии капля жидкости, представленная сама себе, принимает форму шара, при которой ее поверхность для данного объема будет наименьшей.
Причиной поверхностного натяжения является наличие взаимного притяжения молекул жидкости. Рассмотрим две молекулы жидкости – одну А, находящуюся на поверхности, и вторую В – во внутренних слоях жидкости. (Рис. 13.1). Описав вокруг них сферы радиусом r, равным расстоянию, на котором действуют силы межмолекулярного натяжения, убедимся, что силовое состояние молекул различно. На молекулу В силы притяжения действуют симметрично во всех направлениях, и она находится в равновесии. Действие же сил на молекулу А несимметрично, сила притяжения соседних молекул жидкости нижних слоев не будет уравновешиваться силой притяжения молекул верхних слоев, поэтому равнодействующая Р стремится втянуть молекулу внутрь жидкости.
Мерой поверхностного натяжения является работа, необходимая для создания 1см2 поверхности при наличии определенной пограничной среды. Обозначается она σ и измеряется в эргах на 1см2.
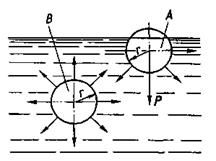
Рис. 13.1 – Схема взаимодействия частиц, находящихся внутри жидкости – В и на ее поверхности – А.
Величина поверхностного натяжения зависит не только от жидкости, но и от среды, которая находится рядом с ней. Например, при наличии воздуха при 20 0С
Н2О – 72,58 эрг/см2
Нg – 471,6 эрг/см2.
Меняя пограничную среду, можно сильно влиять на величину поверхностного натяжения. Например, если вместо воздуха взять бензол, то σH20 = 36,6 эрг/см2, а при контакте с эфиром σH20 = 9,7 эрг/см2.
Вещества, способствующие уменьшению величины поверхностного натяжения, называются поверхностно-активными. К поверхностно-активным относятся группа щелочных и щелочноземельных металлов и их соли. Этим используются при сварке и пайке, стремясь получить лучшее смачивание поверхности твердого металла жидкости и металла в сварочной ванне.
Величина поверхностного натяжения влияет на численные значения упругости паров и растворимость данного вещества. Если жидкость имеет форму капли, то с уменьшением ее размера упругость паров над каплей увеличивается (Рис. 13.2). Например, упругость паров капли радиусом 10-4 см на 0,1% больше упругости паров над плоской поверхностью. Это объясняется влиянием степени кривизны испаряющейся поверхности. Молекуле, находящейся на выпуклой поверхности легче покинуть эту поверхность, чем вогнутую, т.к. равнодействующая сил сцепления здесь меньше. Отсюда следует, что малые капли всегда менее устойчивые, они и растворяются лучше, чем большие.
Существенное влияние на величину поверхности натяжения оказывает изменение температуры. Повышение температуры приводит к снижению поверхностного натяжения для всех веществ, по той причине, что ослабляются силы притяжения между молекулами. При некоторой температуре, поверхностное натяжение жидкости становится равным нулю и исчезает раздел между жидкой и газовой фазой. Эта температура называется температурой абсолютного кипения или критической температурой, выше которой вещество не может находиться в жидком состоянии.
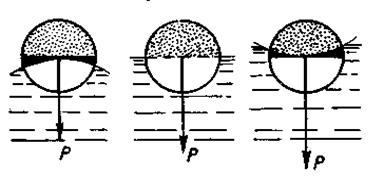

Рис. 13.2 – Влияние степени кривизны испаряющей поверхности на величину силы отрыва от нее частиц.
Существенное влияние на величину поверхности натяжения оказывает изменение температуры. Повышение температуры приводит к снижению поверхностного натяжения для всех веществ, по той причине, что ослабляются силы притяжения между молекулами. При некоторой температуре, поверхностное натяжение жидкости становится равным нулю и исчезает раздел между жидкой и газовой фазой. Эта температура называется температурой абсолютного кипения или критической температурой, выше которой вещество не может находиться в жидком состоянии.
С явлением поверхностного натяжения жидкостей тесно связана адсорбция. Адсорбцией называется процесс присоединения поверхностью атомов других веществ (чаще всего газов). Это объясняется наличием на поверхности жидкости свободных связей. Если силы связи достаточно велики, то адсорбированный атом останется у поверхности. С увеличением температуры адсорбционная способность поверхности значительно падает т.к. силы связи уменьшаются. Процесс адсорбции занимает очень короткий промежуток времени, дальнейшее же перемещение поглощенного вещества осуществляется гораздо медленней – за счет диффузии или механического перемешивания.
Дата добавления: 2016-12-09; просмотров: 1823;











