Явления в жидких средах и на поверхностях раздела фаз
В зоне сварки плавлением весьма важное значение имеют процессы, протекающие в жидких фазах и на границе раздела фаз. Фазой в физической химии называется однородная часть системы, отделенная от других ее частей видимыми поверхностями раздела. Фазой в зоне сварки являются газовая среда, жидкий металл, жидкий шлак, твердый металл.
12.1 Растворение газов. Допустим, что есть двухфазная система, состоящая из газовой и жидкой фаз, и один из компонентов газовой фазы может растворяться в жидкой фазе.
При заданной температуре скорость растворения газа в жидкой фазе можно считать пропорциональной его парциальному давлению Р в газовой фазе, а скорость его удаления из жидкости v – пропорциональной его концентрации С в жидкой фазе. Для равновесных условий, когда v1 = v2 , получим
k1 Р = k2С, или С/Р = k1/k2, т. е. С = kР , где (12.1)
k – константа Генри, определяющая растворимость газа в жидкости при данной температуре, k = k1/k2
Р – парциальное давление газа в газовой фазе, атм.
Эта зависимость была установлена Генри и названа законом Генри. Закон Генри справедлив лишь при малой растворимости и в том случае, если растворенный газ не вступает с жидкостью в химические реакции. Этот закон применим к идеальным и разбавленным растворам, и допускает любой способ выражения концентрации (моль/л, мольные доли и др.)
В жидком металле растворяются газы, находящиеся в атомарном состоянии, и те из них, которые имеют незаполненные валентные оболочки (H, N) и не образуют с металлом ионных связей (подобно кислороду). Обычным состоянием таких газов, является молекулярное, поэтому перед растворением должна пройти их диссоциация, то есть
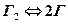
с константой равновесия 
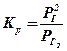
 , то есть
, то есть 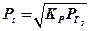
Подставляя значение парциального давления газа 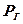 в уравнение (54) получим зависимость, известную как закон Сивертса:
в уравнение (54) получим зависимость, известную как закон Сивертса:
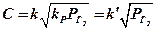 (12.2)
(12.2)
Здесь 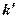 – константа растворимости, она зависит от температуры и природы растворителя.
– константа растворимости, она зависит от температуры и природы растворителя.
Зависимость от температуры та же, что и константы равновесия химической реакции:
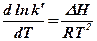
Где 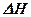 – изменение энтальпии при растворении.
– изменение энтальпии при растворении.
При растворении газов в жидком металле в большинстве случаев ΔН > 0, поэтому с повышением температуры их растворимость возрастает. Количество растворяющегося газа зависит от температуры следующим образом
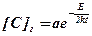 , (12.3)
, (12.3)
где a, k – константы
Е – теплота растворения
Т – абсолютная температура.
Из уравнения (12.3) следует, что с увеличением температуры металла повышается растворимость в нем газа. Однако нельзя забывать, что при температурах, близких к температуре кипения металла, растворимость газа заметно падает и с переходом металла в состояние кипения становиться равной нулю.
12.2 Закон распределения вещества в несмешивающихся растворителях
Рассмотрим систему, состоящую из двух жидких фаз А и В, не растворяющихся одна в другой, и третьей – газовой фазы, один из компонентов которой может растворяться как в фазе А, так и в фазе В.
В соответствии с законом Генри можно записать, что концентрация газа в каждой из фаз при одной и той же температуре:
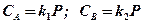 ,
,
откуда следует, что
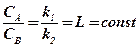 (12.4)
(12.4)
Постоянная L называется коэффициентом или константой распределения, и это соотношение является математическим выражением закона распределения Нернста. Этот закон применим к веществу, находящемуся в любом агрегатном состоянии. Формулировка закона распределения такова: «Каждое вещество распределяется между двумя растворителями так, что отношение концентраций его в обоих растворителях остается постоянным».
В зоне сварки плавлением имеются два несмешивающихся растворителя – это жидкие металл и шлак. Способность некоторых соединений растворяться в этих двух фазах используется для очистки металла от таких соединений. Так при сварке сталей в жидком металле может образовываться монооксид железа, ухудшающий все свойства стали. Монооксид железа хорошо растворим и в металле и в шлаке, его распределение подчиняется закону Нернста:
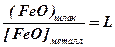
Уменьшение свободной закиси железа в шлаке вызовет уменьшение ее содержание в металле. На этом основано диффузионное раскисление металла. Таким же образом можно освободиться от серы в металле.
Дата добавления: 2016-12-09; просмотров: 2335;











