О химическом равновесии
Равновесием называется термодинамическое состояние химической системы, не изменяющееся во времени при данных внешних условиях ее существования и характеризующееся минимальным значением изотермных потенциалов.
Равновесие химических реакций динамическое, подвижное, так как в такой системе одновременно протекают взаимно противоположные процессы: образование из исходных веществ продуктов реакции и из продуктов реакции – исходных веществ. О совершающихся в химической системе превращениях можно судить по уравнениям реакций. Они дают наглядное представление о ходе химического процесса, позволяют установить количественные соотношения между участвующими веществами и выполнять разнообразные расчёты, связанные с количественной стороной процесса. Однако из химического уравнения не ясно, какому соотношению между исходными веществами и продуктами реакции отвечает состояние равновесия, и в каком положении относительно равновесия будет находиться данная реакция.
9.1. Закон действующих масс и константа равновесия.
Химическое равновесие в гомогенной среде.
Гомогенной называется такая система, внутри которой нет поверхностей раздела, отделяющих одну часть системы от другой. Это может быть, например, газовая смесь, различные жидкие растворы и др.
Рассмотрим химическую реакцию между газообразными веществами:
аА + вВ = сС + dD, (9.1)
где а, в, с, d – стехиометрические коэффициенты или число молей веществ A, B, C, D соответственно.
В таком виде химическое уравнение говорит о том, что реакция одновременно идет в обоих направлениях. Примем, что в направлении слева направо реакция идет с положительным тепловым эффектом.
Если в начальный период скорости протекания реакции в прямом и обратном направлениях не одинаковы, то по мере приближения к состоянию равновесия они становятся близкими друг к другу, а при равновесии достигают равных значений. В таком состоянии системы суммы химических потенциалов исходных веществ и продуктов реакции должны быть равны друг другу.
При заданных внешних условиях наибольшее влияние на скорость протекания реакции оказывает концентрация реагирующих веществ. Зависимость между этими величинами определяется законом действующих масс, согласно которому при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждое из них влияет на скорость в степени, равной стехиометрическому коэффициенту в уравнении реакции.
Следовательно, для состояния равновесия реакции (9.1) должно быть выдержано условие
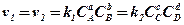 , где
, где
k1 и k2 – константы скоростей реакции;
СА, СВ, СС, СD – концентрации веществ, выраженные в молях на литр.
Тогда
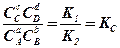 , где (9.2)
, где (9.2)
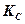 – константа равновесия реакции.
– константа равновесия реакции.
Таким образом, в состоянии равновесия отношение произведений концентраций веществ, стоящих в правой части уравнения, к произведению концентраций веществ, стоящих в его левой части, есть величина постоянная.
Константа равновесия реакции может быть выражена и иными путями. Если вещества, участвующие в реакции, газообразные и подчиняются уравнению идеальных газов, то
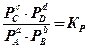 (9.3)
(9.3)
здесь 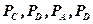 – парциальные давления соответствующих газообразных веществ, атм;
– парциальные давления соответствующих газообразных веществ, атм;
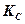 и
и 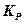 связаны между собой зависимостью
связаны между собой зависимостью
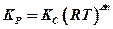 , (9.4)
, (9.4)
где Dn = ( c + d – a – b ) – изменение числа молей веществ в результате реакции.
Естественно, что при Dn = 0
Кр = Кс (9.5)
Следует отметить, что для разбавленных растворов закон действующих масс применим в таком же виде, как и для идеальных газов. Для реальных растворов закон действующих масс применим, если вместо концентраций используются активности веществ.
9.2. Химическое равновесие в гетерогенной среде
Гетерогенной называется такая система, в которой есть поверхность раздела между ее частями или фазами. Такие системы наряду с газовой могут содержать конденсированные фазы – жидкие или твердые. Рассмотрим возможность применения закона действующих масс к подобным системам.
Для примера возьмем реакцию диссоциации углекислого кальция. Ее гетерогенный характер подтверждается тем, что в ней одновременно присутствуют два твердых и одно газообразное вещество:
СаСО3тв = СаОтв + СО2 газ
Наличие в этой реакции веществ в конденсированном, в частности, в твердом состоянии, определяет особенности рассматриваемого процесса. Известно, что нет абсолютно не испаряющихся твердых веществ. Над поверхностью любого из них образуется насыщенный пар, давление или упругость которого в условиях неизменности состава твердых фаз определяется только температурой процесса. Так как упругость паров РCаСО3 и РCаО для данной температуры постоянна и весьма мала, их величина не входит в уравнение константы равновесия и тогда
Кр = РСО2 (9.6)
Как видно из этого равенства для таких реакций применение закона действующих масс достаточно просто: в этом случае константа равновесия определяется парциальным давлением газа.
В подобных процессах реакция может практически дойти до конца, если образующийся газ непрерывно удалять из зоны реакции.
Дата добавления: 2016-12-09; просмотров: 1520;











