Понятие об изотермных потенциалах
Допустим, имеем какой-либо изотермический обратимый процесс, протекающий при постоянном объеме.
Выразим для такого процесса количество тепла dQ из уравнений первого и второго начал термодинамики и затем решим совместно эти уравнения. Из уравнения первого начала термодинамики следует, что dQ = dU+dA; из уравнения второго начала – dQ = TdS. Тогда
dU + dA = TdS
Проинтегрируем это выражение, считая, что вследствие изотермического характера процесса T = const
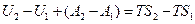

Работа изотермического обратимого процесса является максимальной, то есть 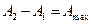
 ,
,
Очевидно
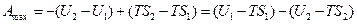

Обозначив U – TS через F, получим
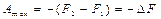

Следовательно, изотермическая работа системы при постоянном объеме равна убыли функции F данного процесса.
Функция F называется свободной энергией, являющейся частью внутренней энергии системы (U – TS). Ту часть внутренней энергии, которая не превращается в работу TS, называют связанной или бесполезной энергией. Чем больше энтропия системы, тем выше ее связанная энергия.
Свободную энергию F процесса называют также изохорно-изотермным потенциалом.
В процессах, протекающих при постоянном давлении, максимальная работа может быть представлена в виде разности двух значений некоторой функции G, то есть
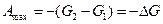
 .
.
Аналогично с предыдущими выкладками
(U + pV) – TS = H – TS
В таких процессах функцию G называют изобарно-изотермным потенциалом. Точно также как энтальпия отличается от внутренней энергии, так изобарный потенциал G отличается от изохорного потенциала на величину pV.
Вычисление изотермных потенциалов для стандартных условий производят, пользуясь табличными значениями величин теплового эффекта и энтропии для веществ, участвующих в реакции, по следующим уравнениям:
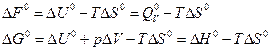

Величины 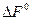
 и
и 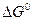
 соединений есть изменение изохорного и изобарного потенциалов, сопровождающих образование этих соединений из свободных элементов в стандартных условиях (при V = constдля
соединений есть изменение изохорного и изобарного потенциалов, сопровождающих образование этих соединений из свободных элементов в стандартных условиях (при V = constдля 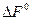 и P = const для
и P = const для 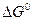 ).
).
В этом случае для свободных элементов 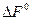 и
и 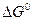 принимаются равными нулю.
принимаются равными нулю.
Для химических реакций величины 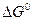 и
и 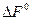 определяются суммированием найденных значений этих потенциалов для соединений, участвующих в реакции; при этом соответствующие величины для веществ, стоящих в правой части уравнения берутся с плюсом, а в левой части с минусом.
определяются суммированием найденных значений этих потенциалов для соединений, участвующих в реакции; при этом соответствующие величины для веществ, стоящих в правой части уравнения берутся с плюсом, а в левой части с минусом.
Зная изотермные потенциалы реакций, протекающих в стандартных условиях, можно определить изотермные потенциалы для иных условий по таким уравнениям:
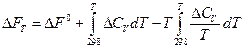
и соответственно
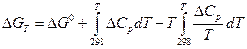

Изотермные потенциалы характеризуют направление протекания самопроизвольных процессов и предел их протекания для изотермических условий в противоположность энтропии, при самопроизвольных процессах они уменьшаются.
При постоянной температуре и объеме в любой системе самопроизвольно протекают только те процессы, которые связаны с уменьшением F, причем пределом их протекания, т.е. условием равновесия является достижение некоторого минимального для данных условий значения F. То же самое можно сказать и для изобарных процессов – G будет стремиться к минимуму. В связи с тем, что большинство сварочных процессов происходит при постоянном давлении, для их анализа особенно важно знать величину изобарно-изотермного потенциала.
Дата добавления: 2016-12-09; просмотров: 1859;











