Влияние давления и температуры на положение химического равновесия
Константа равновесия любой химической реакции имеет постоянное числовое значение при неизменных внешних условиях – давлении и температуре. Если реакция протекает без изменения числа газовых молекул, то изменение объема и давления не влияет на смещение константы равновесия. Если же реакция сопровождается изменением числа газовых молекул, то с возрастанием давления положение равновесия смещается в сторону уменьшения числа образующихся газовых молекул, а с уменьшением давления – в сторону их увеличения. На примере реакции диссоциации углекислого газа
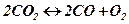
можно заметить, что при заданной температуре увеличение давления приводит к развитию процесса образования молекул углекислого газа, в то время как снижение давления вызывает смещение равновесия в направлении большего выхода монооксида углерода.
Изменение константы равновесия с изменением температуры можно установить, рассматривая совместно уравнения изотермы реакции и Гиббса-Гельмгольца.
Исключим из уравнений (10.4) и (40) значения  . Для этого уравнение (10.4) изотермы реакции
. Для этого уравнение (10.4) изотермы реакции
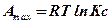
продифференцируем по температуре как по независимой переменной, считая объем постоянным.

Подставим найденное выражение для 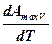 в уравнение Гиббса-Гельмгольца
в уравнение Гиббса-Гельмгольца

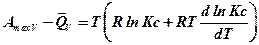
Преобразуем полученное выражение:
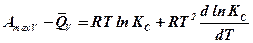 ,
,
откуда с учетом выражения (10.4) получим:
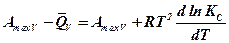
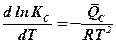 или
или 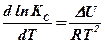 (11.1)
(11.1)
Эта зависимость носит название уравнения изохоры реакции Вант-Гоффа.
Аналогично рассуждая, для реакций, протекающих при постоянном давлении, можно установить влияние изменения температуры на положение константы равновесия с помощью уравнения изобары реакции Вант-Гоффа:
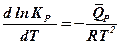 или
или
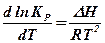 (11.2)
(11.2)
Таким образом, повышение температуры смещает равновесие в направлении изотермического процесса, идущего с поглощением тепла. Чем значительнее тепловой эффект процесса, тем больше меняется константа равновесия и тем сильнее смещается равновесие с изменением температуры.
Выводы, вытекающие из анализа зависимости константы равновесия от температуры, имеют большое значение для изучения металлургических процессов при сварке, поскольку такие процессы протекают в условиях высоких температур.
Рассмотренное влияние давления и температуры на положение химического равновесия, по сути, есть проявление принципа подвижного равновесия, установленного Ле-Шателье в 1884г. Этот принцип заключается в следующем: если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то последнее смещается, причём в системе протекают процессы, ослабляющие эффект внешнего воздействия.
Например, повышение температуры, как установлено ранее, смещает положение равновесия в сторону большего выхода тех веществ, которые образуются с поглощением тепла. Тем самым ослабляется эффект внешнего воздействия – подвода тепла и повышения температуры системы. Понижение температуры системы действует в обратном направлении. Поэтому реакция
Fe + CO = FeO + C + Q
при высоких температурах будет развиваться преимущественно влево, так как это процесс экзотермический.
Таким образом, можно сказать, что переход системы из устойчивого состояния при низкой температуре в относительно устойчивое при высокой температуре всегда сопровождается поглощением тепла (плавление, испарение, превращение a – Fe ® g – Fe и др.). Обратный же переход будет сопровождаться выделением тепла (затвердевание жидкого металла, конденсация пара и др.).
Поскольку процессы сварки обычно протекают в условиях постоянства давления, то наибольшее влияние на смещение равновесия при них оказывает температура.
Дата добавления: 2016-12-09; просмотров: 3024;











