Обобщение первого и второго начала термодинамики.
Используя уравнение первого и второго начала термодинамики, найдем связь между максимальной работой реакции, идущей при постоянном объеме Аmax, теплотой ее QV и абсолютной температурой Т. В соответствии с первым началом термодинамики можно записать
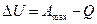

С другой сторон, для выражения второго начала термодинамики воспользуемся формулировкой этого закона, данной Сади Карно.
Если степень использования теплоты для получения работы оценить коэффициентом полезного действия тепловой машины  , то оказывается, что при обратимом цикле работы машины достигаются предельные значения этого КПД. При обратимом цикле Карно
, то оказывается, что при обратимом цикле работы машины достигаются предельные значения этого КПД. При обратимом цикле Карно
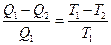
 , где
, где
Q1 – теплота отданная теплоотдатчиком, имеющим температуру Т1, рабочему телу
Q2 – теплота переданная рабочим телом теплоприемнику с более низкой температурой T2
Разность Q1 – Q2 – представляют собой ту часть теплоты, которая пошла на совершение рабочим телом работы. Тогда в общем виде можно записать
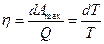

Из этого уравнения вытекает, что переход тепла в работу возможен при наличии температурного перепада (T1 – T2), однако этот переход ограничен, т. к. часть тепла обязательно должна остаться необращенной в работу.
Из предыдущей формулы следует
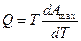

Подставляя выражение для Q в уравнение первого начала термодинамики можно записать
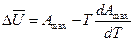


Преобразование этого выражения даст
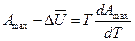
 *
*
Для процессов протекающих при постоянном объеме, считая что 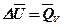
 , получим
, получим
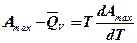 **
**
Уравнения (*) и (**) называются уравнениями Гиббса-Гельмгольца; они обобщают первое и второе начало термодинамики. Из них вытекает такие следствия:
1. Так как величины Amax и 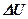 являются переменными, возможно такое соотношение между ними, когда при положительном значении Amax величина QV будет отрицательной, то есть тепловой эффект станет эндотермическим.
являются переменными, возможно такое соотношение между ними, когда при положительном значении Amax величина QV будет отрицательной, то есть тепловой эффект станет эндотермическим.
Возможность протекания эндотермической реакции в этом случае обуславливается такими факторами
А) малым численным значением Amax
Б) протеканием реакции в области высоких температур
В) положительным значением температурного коэффициента работы 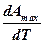 .
.
Следовательно, можно отметить, что в области высоких температур, например в электрической дуге, будут протекать преимущественно эндотермические реакции, в то время как в условиях сниженных температур, например при охлаждении сварочной ванны, следует ожидать более полного протекания экзотермических реакций.
2. Если максимальная работа в рассматриваемом процессе не зависит от температуры, т. е. 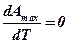 , то она определяется изменением внутренней энергии:
, то она определяется изменением внутренней энергии:
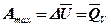
Контрольные вопросы:
1. В чем сущность первого начала термодинамики применительно к химический процессам?
2. В чем сущность закона Гесса?
3. Каким образом определяется тепловой эффект реакции, протекающей при повышенной температуре, отличной от стандартной?
4. Что такое энтальпия? Какова связь между внутренней энергией и энтальпией?
5. В чем сущность второго качала термодинамики применительно к химическим процессам? Что такое энтропия, как можно ее определить?
6. Каков смысл понятия изобарно-изотермного и изохорно-изотермного потенциалов? Что ими оценивается?
7. Какая связь между максимальной работой реакции и изотермическим потенциалом?
8. Определение условий термодинамического равновесия системы.
Дата добавления: 2016-12-09; просмотров: 2153;











