ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Как было показано ранее, химическая термодинамика позволяет установить принципиальную возможность или невозможность самопроизвольного течения химических реакций, а
также рассчитать равновесные концентрации реагирующих веществ. Однако, знание рассмотренных закономерностей еще недостаточно, чтобы предсказать реальную возможность протекания химической реакции, определить скорость реакции и ее механизм, а также управлять процессом. Быстрота реакции зачастую не связана со значением ее энергии Гиббса. Например, термодинамическая вероятность реакции окисления водорода до воды
Н2 + 1/2 O2 = Н2O (ж), ∆ G 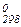 = - 237,2 кДж/моль
= - 237,2 кДж/моль
значительно выше, чем вероятность реакции нейтрализации с образованием воды
H+ + ОН- = Н2O (ж), ∆ G 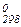 = - 79,9 кДж/моль.
= - 79,9 кДж/моль.
В то же время первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает практически мгновенно. Скорость и механизм химических реакций изучает химическая кинетика.
Общие понятия. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В зависимости от типа химической реакции (гомогенная пи гетерогенная) меняется характер реакционного пространства.
Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной.
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией с, то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
v = (c2 - c1) / (t2 - tl) = -∆ c / ∆ t,
где c2 и c1 - концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции v, равна:
v = ± dc / dt.
Скорость реакции принимается всегда положительной, поэтому, производная исходных концентраций берется со знаком минус, а продуктов реакции - со знаком плюс.
Из определения скорости реакции и анализа уравнения следует, что скорость реакции в СИ имеет единицу измерения [моль∙м-3∙с-1], однако также используются и другие единицы измерения [моль∙л-1∙с-1], [моль∙см-3∙с-1], [моль∙см-3∙мин-1].
В ходе реакции изменяются концентрации всех исходных веществ и продуктов реакции. Если у всех реагентов одинаковые стехиометрические коэффициенты, то изменения их концентраций (по модулю) во времени также одинаковы. Например, для реакции
СО + Н2O (г) = CO2 + Н2
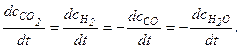
Для реакций с различными стехиометрическими коэффициентами скорости изменения концентраций реагентов будут разными. Для реакции
bВ + dD—> lL + mМ
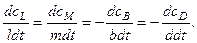
Например, для реакции
CH4 + 2Н2O (г) = СO2 + 4Н2
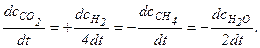
Как видно, концентрация H2O изменяется в 2 раза, а концентрация Н2 - в 4 раза быстрее, чем концентрации СН4 и СO2. Это и понятно, так как в ходе реакции на 1 моль СН4 расходуются 2 моль Н2O и образуются 1 моль СO2 и 4 моль Н2. Поэтому в уравнении скорости реакции указывают конкретный реагент (продукт реакции или исходное вещество).
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции, например взрывы, протекают мгновенно, другие могут идти годами. На скорость реакции влияют многие факторы: концентрация реагентов, температура, катализаторы, внешние воздействия, например излучения, пластическая деформация.
Дата добавления: 2016-12-09; просмотров: 1532;











