В) Влияние температуры на равновесие
Опыт показывает, что температура оказывает большое влияние на состав равновесной смеси, в одних реакциях увеличивая содержание продуктов реакции, в других - уменьшая. Количественно эта зависимость отражается уравнениями изобары (1.17) и изохоры (1.18) Вант-Гоффа:
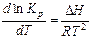 (1.24)
(1.24) 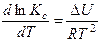 (1.25)
(1.25)
Из этих уравнений видно, что изменение константы равновесия при увеличении температуры (а значит и изменение выхода продукта реакции) определяется знаком теплового эффекта DH и DU:
1.DH>0 или DU>0 - реакция эндотермическая (с поглощением тепла). Правые части уравнений больше нуля, это означает, что и производные больше нуля:
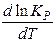 > 0;
> 0; 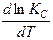 > 0
> 0
Таким образом, функции lnKp и lnKc (а также Kp и Kc) увеличиваются с ростом температуры.
2.DH<0 или DU<0 - реакция экзотермическая (с выделением тепла).
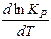 < 0;
< 0; 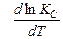 < 0
< 0
Константа равновесия убывает с ростом температуры, т.е. убывает содержание продуктов реакции в равновесной смеси, а увеличивается содержание исходных веществ.
Таким образом, повышение температуры способствует более полному протеканию эндотермических процессов. Проинтегрируем уравнение изобары.
Пусть DH¹f(Т) разделим переменные и интегрируем,


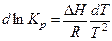 ;
; 
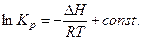 (1.26)
(1.26)
Как видим, константа равновесия зависит от температуры по экспоненциальному закону: 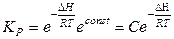 , а в координатах ln K = f(
, а в координатах ln K = f(  ) зависимость линейная (уравнение 1.26, рисунок 1.7)
) зависимость линейная (уравнение 1.26, рисунок 1.7)
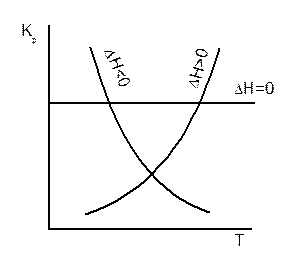
| 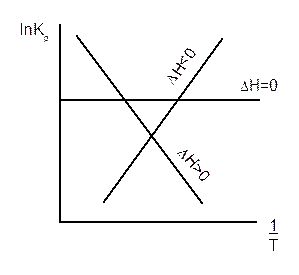
|
Рисунок 1.7 – Температурная зависимость константы равновесия
Определенное интегрирование уравнения изобары дает:
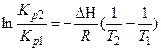 (1.27)
(1.27)
Зная величину константы равновесия при одной какой-либо температуре, можно найти Кр при любой другой при известном значении DH.
Дата добавления: 2016-06-22; просмотров: 2558;











