Влияние температуры на химическое равновесие
Для химической реакции, протекающей при р, Т = const:
аА + вВ = eЕ + lL,
стандартное изменение энергии Гиббса равно
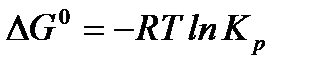 .
.
Так как
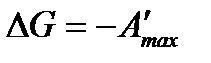
получим
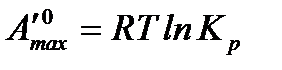 , (3.3)
, (3.3)
где 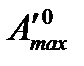 – максимальная полезная работа реакции, протекающей в стандартных условиях
– максимальная полезная работа реакции, протекающей в стандартных условиях
Максимальная работа процесса в соответствии с уравнением Гиббса-Гельмгольца равна:
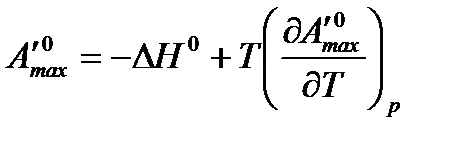 .
.
Для того чтобы найти производную 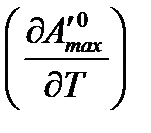 продифференцируем уравнение (3.3) по температуре:
продифференцируем уравнение (3.3) по температуре:
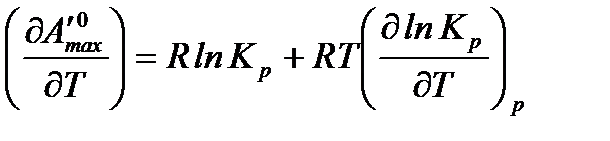 .
.
Подставим в уравнение максимальной работы Гиббса-Гельмгольца выражения для максимальной работы и ее производной по температуре:
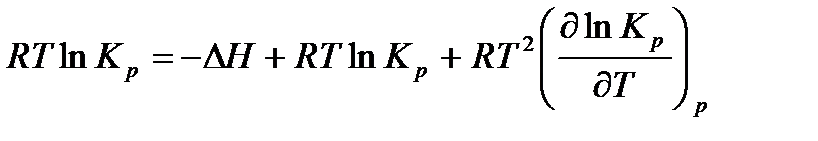 .
.
Отсюда получим
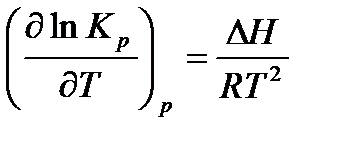 (3.4)
(3.4)
Полученное уравнение называется уравнением изобары Вант-Гоффа.
Аналогично при V, T = const получаем уравнение изохоры Вант-Гоффа:
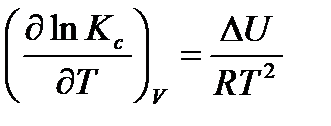 (3.5)
(3.5)
Полученные уравнения (3.4), (3.5) характеризуют влияние температуры на константу химического равновесия и позволяют спрогнозировать изменение константы химического равновесия при изменении температуры.
Проанализируем уравнения. Знак производной, стоящей в левой части уравнений, а, следовательно, и направление изменения константы равновесия при изменении Т определяется знаком теплового эффекта химической реакции. Если реакция эндотермическая (ΔН > 0), то с увеличением температуры Кр возрастает и равновесие смещается в сторону продуктов реакции. Если реакция экзотермическая
(ΔН < 0), то Кр убывает, в этом случае при увеличении температуры равновесие смещается в сторону исходных веществ. Если реакция протекает без теплового эффекта, то температура на химическое равновесие не влияет.
Разделим переменные в уравнении изобары
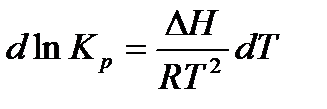
Проинтегрируем уравнение в небольшом интервале температур, считая, что ΔН не зависит от температуры:
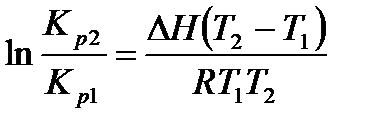 .
.
Применяя полученное уравнение, можно рассчитать средний тепловой эффект реакции, если известны значения констант равновесия в узком интервале температур или рассчитать Кp2, если известно Кр1 и средняя величина теплового эффекта реакции.
| Кр |
| Т |
| ΔН < 0 |
| ΔН > 0 |
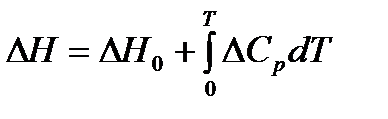 .
.
Раздел IV. Электрохимия
Электрохимия – это раздел физической химии, изучающий взаимосвязь химических процессов и электрических явлений.
Процессы, которые изучаются в данном разделе протекают в растворах или расплавах электролитов и связаны с изменением состояния ионов. Поэтому электрохимия изучает свойства растворов электролитов, ионные равновесия и электродные процессы.
Электролиты – это химические соединения, которые в растворе полностью или частично диссоциируют на ионы. Различают сильные и слабыеэлектролиты. Сильные электролиты диссоциируют в растворе практически полностью (сильные кислоты, основания, соли). Слабые электролиты диссоциируют в растворе только частично (органические кислоты, фенолы, амины). Доля распавшихся на ионы молекул NД из числа первоначально взятых N называется степенью диссоциации:
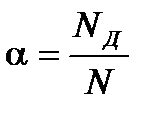 , 0 ≤ α ≤ 1.
, 0 ≤ α ≤ 1.
Дата добавления: 2016-06-22; просмотров: 2835;











