Энергия Гиббса. Направленность
Химических реакций
Если равенство энтальпийного и энтропийного факторов процесса, протекающего в изобарно – изотермических условиях, свидетельствует о равновесном состоянии системы (при p = const и T = const), то разность между ними
∆ H - T ∆ S = ∆ G
является критерием направления и предела самопроизвольного протекания изобарно – изотермического процесса. Термодинамическая функция состояния системы G = H - T S называется энергией Гиббса, а ∆ G – изменением энергий Гиббса химической реакции.
Энергия Гиббса химической реакции является изменением термодинамической функции состояния системы, не зависит от пути перехода, а определяется начальным и конечным состоянием системы:
∆ G = G2 – G1,
где G1 и G2 – энергия Гиббса системы в состоянии 1 и 2 соответственно.
При расчете энергии Гиббса химической реакции следует иметь в виду, что
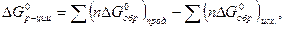
где 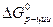 - стандартная энергия Гиббса химической реакции,
- стандартная энергия Гиббса химической реакции, 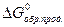 и
и 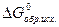 - стандартные энергии Гиббса образования продуктов реакции и исходных веществ.
- стандартные энергии Гиббса образования продуктов реакции и исходных веществ.
Стандартной энергией Гиббса образования химического соединения 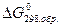 называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях.
называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих простых веществ, также находящихся в стандартных состояниях и термодинамики устойчивых при данной температуре, фазах и модификациях.
Стандартные энергии Гиббса образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
В изобарно – изотермических условиях реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы (G2 < G1). Поэтому условием самопроизвольного течения реакции при заданных p и T является неравенство ∆ Gp, T < 0.
Увеличение изобарного потенциала ∆ G > 0 свидетельствует о невозможности осуществления процесса в данных условиях. Если же ∆ G = 0, то система находится в состоянии равновесия.
Пример. Определить, возможен ли процесс при стандартных условиях
CuO(т.) + CO(г.) = Cu(т.) + CO(г.)
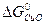 = -127 кДж/моль;
= -127 кДж/моль; 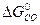 = -137, 14 кДж/моль;
= -137, 14 кДж/моль;
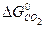 = -394, 38 кДж/моль;
= -394, 38 кДж/моль;
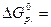
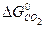 - (
- ( 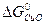 +
+ 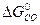 )
)
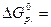 -394, 38 – ( - 127 – 137, 14) = -130, 24 кДж
-394, 38 – ( - 127 – 137, 14) = -130, 24 кДж
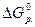 < 0, следовательно, данная реакция протекает самопро-
< 0, следовательно, данная реакция протекает самопро-
извольно и необратимо в стандартных условиях.
Факторы, определяющие возможность процесса. Величина стандартной энергии Гиббса химической реакции ∆ G0 не может быть критерием направления или предела самопроизвольного протекания процесса в условиях, отличных от стандартных. Это затрудняет использование энергии Гиббса для оценки процессов, протекающих в реальных условиях. И только для получения сугубо ориентированных данных можно считать, что 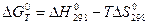
Направление химических реакций зависит от их характера. Так, для экзотермических реакций (∆ H < 0), у которых в процессе их протекания возрастает число газообразных веществ (∆ S > 0) ∆ G < 0 при любых температурах. Такие реакции протекают самопроизвольно и являются необратимыми. Примером является реакция разложения перекиси водорода:
2H2O2 (г.) → 2H2O (г.) + O2 (г.)
∆H = -211 кДж, ∆S = 129,6 Дж/К; ∆G = - 250 кДж.
Эндотермические реакции (∆ H > 0), в результате которых уменьшается число молей газообразных веществ (∆ S < 0), самопроизвольно в прямом направлении протекать не могут, поскольку для таких реакций ∆ G > 0 при любых температурах. Примером такой реакции является окисление азота.
N2 (г) + 2O2 (г) = 2NO2 (n)
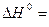 67,7 кДж;
67,7 кДж; 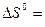 - 120 Дж/К;
- 120 Дж/К; 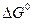 = 103,7 кДж.
= 103,7 кДж.
Направление химических реакций зависит не только от энтальпийного и энтропийного факторов, но и от температуры. Если в результате экзотермической реакции (∆ H < 0) уменьшается число молей газообразных веществ (∆ S < 0), то самопроизвольно они могут протекать при низких температурах. Примером такой реакции является синтез аммиака:
3H2 (г) + N2 (г.) = 2NH3 (г.)
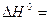 - 92 кДж;
- 92 кДж; 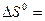 - 198 Дж/К;
- 198 Дж/К; 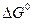 = - 33,4 кДж.
= - 33,4 кДж.
В стандартных условиях (T = 298 К) эта реакция возможна, однако при T > 298 К реакция в прямом направлении становится невозможной. (∆ G > 0).
Для определения температуры, ниже которой ∆ G < 0, необходимо определить температуру равновесного состояния Tp., когда ∆ G = ∆ H - ∆ S∙ Tp.= 0, откуда Tp = 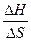 .
.
Если в результате эндотермической реакции (∆ H > 0) увеличивается число молей газообразных веществ (∆ S > 0), то при невысоких температурах, когда │∆ H│ > │T ∆ S│, самопроизвольно прямая реакция протекать не может (∆ G > 0). В прямом направлении реакции будет протекать при условии, если T > Tp, когда │∆ H│ < │T ∆ S│ и ∆ G < 0. Например, эта реакция получения водорода при взаимодействии метана и водяного пара:
CH4 (г) + 2H2O (г) = CO2 (г) + 4H2 (г)
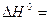 164,9 кДж;
164,9 кДж; 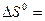 172,41 Дж/моль∙К;
172,41 Дж/моль∙К;
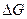 = 110,3 кДж.
= 110,3 кДж.
Как видно в стандартных условиях эта реакция самопроизвольно в прямом направлении идти не может (∆ G > 0). Однако при температуре выше T p = 962 К реакция становится возможной, поскольку ∆ G < 0.
Глава 6. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
Дата добавления: 2016-12-09; просмотров: 3292;











