Химическое равновесие
Многие химические реакции протекают обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается (в большем или меньшем количестве) каждое из исходных веществ. В ходе обратимой химической реакции концентрации исходных веществ уменьшаются, а продуктов - возрастают. Это сопровождается увеличением скорости обратной реакции 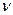 ← и уменьшением скорости прямой реакции
← и уменьшением скорости прямой реакции 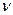 →. Если в системе наступает состояние, при котором
→. Если в системе наступает состояние, при котором 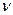 → =
→ = 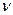 ←, то его называют химическим равновесием.
←, то его называют химическим равновесием.
Истинное химическое равновесие характеризуется тремя признаками: в системе не происходит видимых во времени изменений при отсутствии внешнего воздействия; равновесие достигается как при прямой, так и при обратной реакции (рис. 51), самое малое внешнее воздействие легко и незначительно смещает равновесие в ту или в другую сторону.
Примером обратимой реакции является образование иодоводорода:
H2 + I2 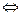 2HI
2HI
которая при 4440 С и давлением в 0,1 МПа прекращается после образования 78 % НI. Эта концентрация отвечает состоянию химического равновесия. Не изменяя температуры и давления, нельзя получить больше, чем 78 % НI.
В случае обратимой химической реакции
aA + bB 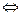 cC + dD
cC + dD
Зависимость скоростей прямой ( 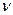 →) и обратной (
→) и обратной ( 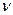 ←) реакции от концентраций реагирующих веществ выражается соотношениями
←) реакции от концентраций реагирующих веществ выражается соотношениями
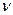 → = K→ ∙ [A] a ∙ [B] b
→ = K→ ∙ [A] a ∙ [B] b
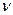 ← = K ← ∙ [C] c ∙ [D] d
← = K ← ∙ [C] c ∙ [D] d
В состоянии химического равновесия 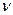 → =
→ = 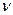 ←, т.е.
←, т.е.
K→ ∙ [A] a ∙ [B] b = K ← ∙ [C] c ∙ [D] d
Отсюда
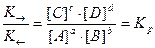
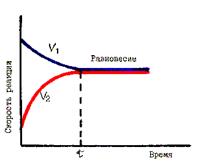
Рис. 51. Установление химического равновесия
где Kp - константа равновесия реакции. Kp - основная количественная характеристика химического равновесия.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Kp - постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше Kp, тем более глубоко протекает реакция, т.е. тем больше выход ее продуктов. Kp зависит от природы реагентов, температуры и не зависит от исходных концентраций веществ в системе.
Например, для реакции:
4HCl + O2  2Cl2 + 2H2O Kp = 1,2 ∙ 1016
2Cl2 + 2H2O Kp = 1,2 ∙ 1016
Для реакции диссоциации угольной кислоты
H2CO3  H+ + HCO
H+ + HCO 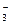 Kp = 4,4 ∙ 10-7
Kp = 4,4 ∙ 10-7
Если обратимая реакция протекает в гетерогенной системе, например
FeO (к) + CO (г) 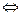 Fe (к) + CO2 (г),
Fe (к) + CO2 (г),
то константа равновесия Kp равна отношению равновесных парциальных давлений газообразных веществ (CО2 и СО) и не зависит от абсолютных и относительных количеств веществ, находящихся в конденсированной фазе (Fe и FeO):
Kp = 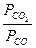
Зависимость Kp от температуры при p = const выражается уравнением изобары химической реакции:
ln Kp = 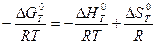
Если 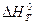 < 0,то константа равновесия при повышении температуры уменьшается. Если
< 0,то константа равновесия при повышении температуры уменьшается. Если 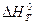 > 0 (эндотермическая реакция), то величина Kp при повышении температуры увеличивается.
> 0 (эндотермическая реакция), то величина Kp при повышении температуры увеличивается.
Зависимость константы равновесия от температуры при V = const выражается уравнением изохоры химической реакции:
ln Kp = 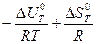
Принцип Ле Шателье. При изменении условий протекания реакции (T, P, C какого либо из веществ) скорости прямого и обратимого процессов изменяются неодинаково и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Так повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы.
Например, для обратимой экзотермической реакции
N2 (г) + 3H2 (г) 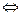 2NH3 (г),
2NH3 (г), 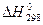 = - 91 кДж
= - 91 кДж
Повышение температуры будет смещать равновесие влево, в сторону разложения аммиака на N2 и Н2. Например, выход аммиака для этой реакции при 300 0С и 20 МПа составляет 64%, а при 600 0С и том же давлении - всего 8 %.
Повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления. При увеличении давления, например, в реакции синтеза аммиака (рассмотренной выше), выход продукта возрастает. В частности при 300 0С и при давлении 100 МПа выход аммиака достигает 92 %.
При увеличении концентрации, например, исходных веществ сдвиг равновесия произойдет в сторону образования продуктов реакции. Например, при увеличении концентрации азота или водорода равновесие реакции сместится в сторону образования аммиака.
Константа равновесия Kp химической реакции связана со стандартным изменением энергии Гиббса этой реакции 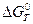 уравнением:
уравнением:
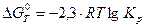
При 298 К это уравнение имеет вид:
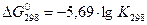
Видно, что Δ G < 0 в том случае, если 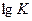 > 0, т.к. K > 1, а положительный (Δ G0 > 0), если
> 0, т.к. K > 1, а положительный (Δ G0 > 0), если 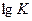 < 0, т.е. K < 1. Это значит, что при отрицательных значениях Δ G0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик; при Δ G0 > 0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
< 0, т.е. K < 1. Это значит, что при отрицательных значениях Δ G0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик; при Δ G0 > 0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
Цепные реакции

Молекула A ↑↓ B с ковалентной связью между атомами А и В в активированном состоянии может распадаться на ионы:


A ↑↓ B→A++ ↑↓ B-(а),
а также и атомы (или свободные радикалы):



A ↑↓ B → A ↑ + ↓ B (б)
В реакции (а) разрыв связи называется гетеролическим или ионным, в реакции (б) гомолитическим или радикальным.
Существует два типа цепных реакций; с неразветвленными и разветвленными цепями. Примером с разветвленными цепями может служить фотохимический синтез хлорида водорода, который протекает со взрывом при облучении смеси водорода и хлора солнечным светом. Для цепных реакций характерны три стадии;
а) стадия зарождения цепи

 Cl2 + h
Cl2 + h 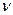 →Cl ↓ + ↑ Cl
→Cl ↓ + ↑ Cl
б) стадия развития цепи

 Cl ↓ + H2 → HCl + ↓ H
Cl ↓ + H2 → HCl + ↓ H


H ↓ + Cl2 → HCl + ↓ Cl и т. д.
в) стадия обрыва цепи (столкновения двух атомов)


H ↓ + ↑ H → H2


Cl ↓ + ↑ Cl → Cl2


H ↓ + ↑ Cl → HCl
Цепные реакции с разветвленными цепями протекают так, что каждая активная частица порождает не одну, как в неразветвленной цепи, а минимум две новые активные частицы.
Примером реакции с разветвленными цепями может служить окисление водорода, протекающее при определенных условиях по цепному механизму.
Если пропустить через смесь равных объемов водорода и кислорода электрический заряд (h 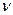 ), то произойдет образование двух свободных радикалов
), то произойдет образование двух свободных радикалов

H2 + O2 → 2 HO ↓ ,
каждый из которых характеризуется высокой активностью.
Новый акт взаимодействия протекает самопроизвольно:


HO ↓ + H2 → H2O + H ↓ ,
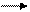

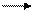
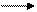
 И далее H ↓ + O2
И далее H ↓ + O2
 HO ↓ + H2
HO ↓ + H2
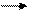
 H2O
H2O

 H ↓ + O2
H ↓ + O2

 H ↓ + O2
H ↓ + O2


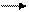 ↓ O ↓ + H2
↓ O ↓ + H2
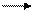 HO ↓ + H2
HO ↓ + H2
По цепному механизму протекают многие химические реакции, например, крекинг и полимеризация, образование смога в атмосфере и др.
Фазовые равновесия
Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми. К их числу можно отнести равновесия в процессах испарения, плавления, конденсации. Для фазовых равновесий справедлив принцип Ле Шателье. Например, H2O (ж) 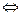 H2O (г)
H2O (г)
Одним из наиболее общих законов гетерогенных (в том числе и фазовых) равновесий является правило фаз. Согласно этому правилу в равновесной системе число фаз Ф, число независимых компонентов К и число степеней свободы связаны соотношением:
С + Ф = К + n,
где n - число внешних факторов, влияющих на равновесие системы. Внешними факторами чаще всего бывают температура и давление, тогда n = 2 и уравнение принимает вид:
С + Ф = К + 2
Число термодинамических степеней свободы С равно числу условий (T, P и С), произвольное которых в известных пределах не меняет числа и вида фаз системы.
По числу степеней свободы системы делят на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2).
К - число компонентов, равно общему числу видов молекул минус число независимых химических реакций.
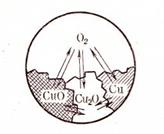
Пример 1. В гетерогенной системе медь - кислород два компонента. Она состоит из четырех различных веществ: Cu, CuO, Cu2O, O2, т. е. из четырех фаз реакции:
2Cu + O2 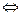 2CuO
2CuO
4Cu + O2  2Cu2O
2Cu2O
Итак, в этой системе имеют место две реакции и число компонентов K = 4 – 2 = 2. Число степеней свободы по графику фаз C = 2 + 2 – 4 = 0. Такая система существует при строго определенной температуре давления кислорода. Система инвариантна (рис. 52).
|
Рис. 52. Схема гетерогенного равновесия
окисления меди кислородом
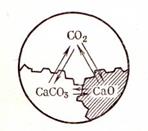
Пример 2. В системе из диссоциирующего карбоната кальция три фазы и два компонента:
CaCO3 → CaO (Т) + CO2 (Г)
|
Число степеней свободы C = 2 + 2 – 3 = 1. Система моновариантная (рис. 53).
Рис. 53. Схема обратимой реакции
диссоциации карбоната кальция
За степень свободы можно принять или температуру, или давление, т. к. эти параметры функционально связанны:
P 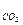 = f1 (T); T = f2 (P
= f1 (T); T = f2 (P 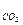 )
)
Если 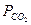 является только температурной функцией, то его можно принять за константу равновесия.
является только температурной функцией, то его можно принять за константу равновесия.
Пример 3. Равновесная система из твердого углерода, оксида и диоксида углерода имеет две фазы и два компонента (K = 3 – 1 = 2):
C (Г) + CO2 (Г) 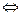 2CO (Г)
2CO (Г)
Число степеней свободы по правилу фаз C = 2 + 2 – 2 = 2. Система бивариантная. В данной системе давление СО2 зависит от температуры и давления или от концентрации СО (рис. 54).
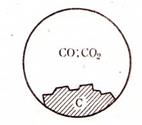
|
Рис. 54. Схема равновесия между твердым
углеродом, CO и CO2
При изучении фазовых равновесий широко применяется графический метод построения диаграмм состояния.
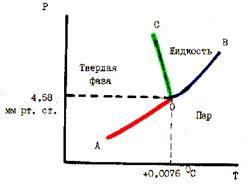
Рис. 55. PT - диаграмма состояния воды
Например, на рис. 55 представлена диаграмма для воды в координатах Р - Т. Линии АО и ОВ ограничивают область пара, линии ОВ и ОС - область жидкости и линии АО и ОС - область твердой фазы. Эта диаграмма описывает фазовые равновесия только при низком давлении.
В любой области однофазной системы С = K + 2 – Ф = 1 + 2 – 1 = 2, т. е. в таких системах можно произвольно изменять два параметра (Р и Т) в некоторых пределах без изменения числа фаз. Это бивариантные системы. Для любой точки на одной из линий - ОА, ОВ, ОС, которые соответствуют равновесию двух фаз число степеней свободы С = 1 + 2 – 2 = 1. Это
моновариантные системы в которых можно изменять один параметр (Р или Т). При наибольшем возможном числе фаз, равном 3, в системе в условиях, определяющих тройную точку О, не остается ни одной степени свободы (С = 0). Это нонвариантная система. Для воды тройная точка отвечает Т = 0,00760 С и Р=4,58 мм. рт. ст. При насыщении воды воздухом с давлением 1 атм. Равновесие воды льда и пара наступает при 00 С. Из рис. 55 видно, что с повышением давления температура плавления льда снижается ( линия ОС наклонена влево). Это является следствием большей плотности воды по сравнению с плотностью льда при равновесии. По принципу Ле Шателье равновесие лед  вода - 6,1 кДж/моль при увеличении давления смешается в сторону воды, имеющей меньший объем. Если теперь при повышенном давлении повышать температуру, то равновесие должно смещаться в сторону льда (с выделением теплоты).
вода - 6,1 кДж/моль при увеличении давления смешается в сторону воды, имеющей меньший объем. Если теперь при повышенном давлении повышать температуру, то равновесие должно смещаться в сторону льда (с выделением теплоты).
Дата добавления: 2016-12-09; просмотров: 2486;











