Катализаторы и каталитические системы
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. В присутствии катализатора изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость. Катализаторы - это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Изменение скорости катализируемой реакции за счет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ (∆ G < 0):
А + В → А…В → АВ
активный
комплекс
Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, с другой стороны, найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии активации), образуя соединение АК:
А + K → А…K → АK
активный
комплекс
Соединение же АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К:
B + АK → B…АK → АB + K
активный
комплекс
Суммируя два последних уравнения, получим
А + В = АВ
т.е. в результате реакции катализатор остался без изменения.
На рис. 56 показана энергетическая диаграмма хода реакции в отсутствие (кривая 1) и в присутствии (кривая 2) катализатора. Как видно на рис. 56, в присутствии катализатора энергия активации реакции снижается на величину ∆ E кат.

Рис. 56. Энергетическая схема хода реакции
в отсутствие и в присутствии катализатора.
∆ E кат – снижение энергии активации
под влиянием катализатора
Влияние катализатора на снижение энергии активации процесса E акт можно проиллюстрировать следующими данными для реакции распада иодида водорода:
2Н1 = Н2 + 12
E акт, кдж
Без катализатора 168
Катализатор Аu 105
Катализатор Pt 59
Поскольку в выражении константы скорости реакции
k = Ze 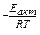 e
e 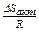
энергия активации входит в отрицательный показатель степени, то даже небольшое уменьшение энергии активации вызывает очень большое увеличение скорости реакции. Так, для рассматриваемой реакции уменьшение энергии активации на 40 кдж соответствует повышению скорости реакции при 500° К в 30000 раз.
В ряде реакций катализатор поставляет свободные радикалы, благодаря чему реакция протекает по цепному механизму. Так, реакция окисления СО кислородом
2СО + О2 = 2СO2
в значительной степени ускоряется в присутствии паров воды, что вызвано развитием цепей с участием свободных радикалов ОН и Н:
·ОН + CO = CO2 + ·Н
·Н + O2 = ·ОН + ·O∙
CO + ·O∙= CO2
Каталитические реакции очень разнообразны. Во многих реакциях каталитическое влияние проявляется в скрытой форме. Сюда, прежде всего, относятся реакции в растворах. Поляризация, диссоциация и ионизация веществ в растворах - виды активации веществ, происходящей под действием растворителя, который, очевидно, играет в этом случае роль катализатора. Большое влияние на скорость и направление процессов оказывают ионы OH  и ОН-.
и ОН-.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный. Примерами гомогенного катализа являются реакции окисления СО (в газовой фазе в присутствии паров воды) и H2SO3 (в растворе в присутствии растворенных оксидов азота) кислородом, а также действие разнообразных ферментов в биологических процессах. Гетерогенно-каталитическими являются процессы синтеза аммиака (катализатор железо), окисления SO2 до SO3 (катализатор платина или оксид ванадия) и т. д.
РАЗДЕЛ третий
РАСТВОРЫ
Дата добавления: 2016-12-09; просмотров: 3172;











