Третий закон термодинамики
Этот закон позволяет приписать абсолютную энтропию всем чистым веществам при любой температуре.
Величины абсолютной энтропии 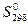 (стандартная энтропия в основном приводится при температуре 298 К и атмосферном давлении и) выражаются в кал/моль К или в энтропийных единицах (э.е.). Для твердых тел величина абсолютной энтропии в среднем равна 10 – 15 э.е. Величина 0,6 э.е. для алмаза свидетельствует о весьма жесткой упорядоченной структуре.
(стандартная энтропия в основном приводится при температуре 298 К и атмосферном давлении и) выражаются в кал/моль К или в энтропийных единицах (э.е.). Для твердых тел величина абсолютной энтропии в среднем равна 10 – 15 э.е. Величина 0,6 э.е. для алмаза свидетельствует о весьма жесткой упорядоченной структуре.
Поскольку можно рассчитать абсолютную энтропию чистых веществ при любой T, можно определить изменение энтропии Δ S для любой химической реакции. Энтропия – функция состояния, поэтому изменение энтропии равно разности между величинами абсолютной энтропии продуктов и реагентов при температуре и давлении, при которых протекает реакция.
Так, для химической реакции
aA + bB +…= dD + eE +…
Изменение энтропии будет
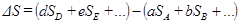 или
или 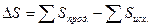
Например, изменение энтропии Δ 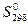 в стандартных условиях для реакции образования хлороводорода рассчитывается следующим образом:
в стандартных условиях для реакции образования хлороводорода рассчитывается следующим образом:
H2 (г) + Cl2 (г) = 2HCl (г)
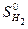 = 130,58 Дж/моль К;
= 130,58 Дж/моль К; 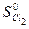 = 222,96 Дж/моль ∙ К;
= 222,96 Дж/моль ∙ К;
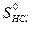 = 186,69 Дж/моль ∙ К
= 186,69 Дж/моль ∙ К
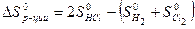
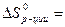 2 ∙ 186,69 – (130,58 + 222,96) = 19,84 Дж/К
2 ∙ 186,69 – (130,58 + 222,96) = 19,84 Дж/К
Изменение энтропии, сопровождающее эту реакцию невелико, поскольку реакция протекает в газовой фазе без изменения числа газообразных молекул.
Если изменение энтальпии ∆ H отражает в основном стремление атомов к объединению в молекулу, т.к. к укрупнению, агрегации, определенному порядку, то величина ∆ S отражает противоположную тенденцию: стремление частиц к разъединению, дроблению, беспорядку.
Движущей силой процесса, протекающего в изобарно – изотермических условиях может быть или стремление системы перейти в состояние с наименьшей энергией, т.е. выделить теплоту в окружающую среду, уменьшить энтальпию (стремление к порядку), или стремление системы перейти в состояние с наибольшей термодинамической вероятностью, т.е. увеличить энтропию (стремление к беспорядку). Если процесс протекает так, что ∆ H = 0, то рост энтропии становится его единственной движущей силой. И, наоборот, при условии ∆ S = 0 единственной движущей силой процесса является убыль энтальпии. В связи с этим можно говорить об энтальпийном ∆ H и энтропийном T ∆S факторах процесса, равенству которых ∆ H = T ∆ S отвечает наиболее устойчивое при данных условиях равновесное состояние системы. Вывести эту систему из равновесного состояния можно только внешним воздействием (изменением T, p и т.п.)
Дата добавления: 2016-12-09; просмотров: 2030;











