Влияние внешних факторов на скорость
Химических реакций
Влияние концентрации. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов) зависимость скорости реакции от концентрации определяется законом действия масс (1867 г. К. Гульдберг, П. Вааге):
Скорость реакции, протекающей в гомогенной среде при постоянной температуре прямопропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Например, для реакции типа А + B2 → AB2 закон действия масс выражается следующим образом:
v = [A] ∙ [B2] или v = k ∙CA∙CB  , где [A] или CA, [B2] или CB
, где [A] или CA, [B2] или CB  - молярные концентрации веществ А и В2; v - скорость прямой реакции; k - коэффициент пропорциональности, называемой константой скорости химической реакции (при CA = CB
- молярные концентрации веществ А и В2; v - скорость прямой реакции; k - коэффициент пропорциональности, называемой константой скорости химической реакции (при CA = CB  = 1 моль/л k численно равна v).
= 1 моль/л k численно равна v).
Константа скорости реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ.
Влияние природы реагирующих веществ. Влияние природы реагирующих веществ. Влияние природы реагирующих веществ можно проследить на примере следующих реакций протекающих при комнатной температуре:
2NO +O2 →2NO2
CH4 + 2O2 →CO2 + 2H2O
Первая реакция протекает умеренно, а вторая - практически не протекает. Различие в скоростях реакций объясняется
специфическими свойствами реагирующих веществ - NO и CH4.
Химические реакции, в которых происходит разрыв нескольких связей, и образуются новые связи при комнатной температуре, протекает медленно. Так в первой реакции разрывается одна связь и образуется две связи, а во второй - разрывается шесть связей и поэтому реакция идет очень медленно.
Необходимое условие протекания химических реакций - столкновение реагирующих частиц - атомов или молекул. В результате столкновений могут происходить перегруппировки атомов и возникновение новых химических связей, в результа-
те чего образуются новые вещества.
Чаще всего химическая связь образуется при столкновении двух частиц и гораздо реже - при столкновении трех частиц. Например, реакция типа А + 2B → AB2 может протекать по механизму тройных столкновений:
А + B + B → AB2
В этом случае, в соответствии с законом действующих масс можно записать:
v = k [A] ∙ [B] ∙ [B], т.е. v = [A] ∙ [B] 2 или v = ∙CA∙CB 2.
Одновременное столкновение более чем трех частиц крайне маловероятно. Поэтому реакции, в уравнениях которых входит большое число частиц, протекают в несколько простых стадий, каждая из которых осуществляется в результате столкновения двух, реже трех частиц. Закон действия масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Изучение этих стадий позволяет раскрыть механизм реакции.
Та стадия, скорость которой минимальна, определяет или лимитирует скорость реакции, в общем. Поэтому математическое выражение закона действия масс, записанное для самой медленной стадии процесса, приложимо одновременно и ко всей реакции в целом.
Например, окисление газообразного бромистого водорода протекает по уравнению:
HBr (г) + O2 (г) → 2 H2O (г) + 2Br2 (г)
Предполагается, что эта реакция состоит из следующих стадий:
HBr + O2 → HOOBr - медленная реакция.
HOOBr + HBr → 2HOBr - быстрая реакция
HOBr + HBr → H2O + Br2 - быстрая реакция
Самая замедленная стадия определяет скорость всей реакции окисления бромистого водорода
v = k ∙СHBr ∙ CO  - первая стадия.
- первая стадия.
В химической кинетике взаимодействия классифицируют или по признаку молекулярности или по признаку порядка реакции.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения.
Примером мономолекулярной реакции может служить термическая диссоциация газообразного йода:
I2 → 2I;
Бимолекулярной - разложение иодида водорода:
2HI → H2 + I2
Тримолекулярной - взаимодействие оксида азота с водородом:
2NO + H2 → N2O + H2O
Порядок реакции определяется зависимостью скорости реакции от концентрации каждого из исходных веществ при условии t = const.
Например, к реакциям первого порядка относится термическая диссоциация газообразного йода: I2→2I ( 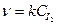 )
)
К реакциям второго порядка относятся реакции:
H2 + I2 → 2HI; 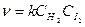
CH3Br + KOH → CH3OH + KBr; 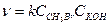
Влияние температуры.С повышением температуры увеличивается скорость движения молекул, что вызывает возрастание числа столкновений между ними и увеличение скорости химических реакций.
Количественно зависимость скорости гомогенных реакций от температуры выражается правилом Вант - Гоффа: при повышении температуры на каждые 100 скорость гомогенных химических реакций увеличивается в два - четыре раза.
Математически это правило может быть выражено уравнением:
v 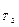 = v
= v 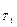 ∙
∙ 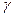
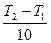
где 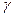 - температурный коэффициент скорости реакции;
- температурный коэффициент скорости реакции;
v 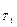 v
v 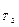 - скорости реакции при температуре T1 и T2.
- скорости реакции при температуре T1 и T2.
Например, если 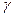 = 2 и T2 - T1 = 1000, то
= 2 и T2 - T1 = 1000, то 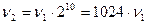 , т.е. скорость реакции при повышении температуры на 1000 увеличивается приблизительно в 1000 раз.
, т.е. скорость реакции при повышении температуры на 1000 увеличивается приблизительно в 1000 раз.
Энергия активации. При концентрации реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости К. Уравнение Вант - Гоффа примет вид:
K 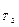 = K
= K 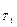 ∙
∙ 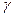
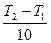
Это уравнение показывает, что К зависит от температуры также как и скорость.
Это уравнение лишь приближенно оценивает зависимости 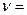 f (T) и K = f (T). Функциональную зависимость константы скорости химической реакции от температуры установил в 1889 году шведский ученый С. Аррениус:
f (T) и K = f (T). Функциональную зависимость константы скорости химической реакции от температуры установил в 1889 году шведский ученый С. Аррениус:
K = A 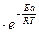
где е - основание натуральных логарифмов (e = 2.718…);
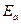 - энергия активации;
- энергия активации;
R - газовая постоянная;
T - температура;
A - предэкспоненциональный множитель (постоянный для данного случая).
После логарифмирования уравнение принимает вид:
ln K = - 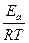 + ln A
+ ln A
Из этого уравнения следует, что зависимость константы скорости химической реакции от температуры, построенная в координатах ln K - 1/Т, линейна. Эта зависимость позволяет определить энергию активации реакции 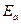 по тангенсу угла наклона прямой и предэкспоненциальный множитель А по отрезку, отсекаемому прямой на оси ординат, когда 1/Т = 0 (рис. 48)
по тангенсу угла наклона прямой и предэкспоненциальный множитель А по отрезку, отсекаемому прямой на оси ординат, когда 1/Т = 0 (рис. 48)
В уравнение Аррениуса входят две величины Е и А, являющиеся некоторыми характеристиками каждой реакции.
Необходимым условием начала химического взаимодействия между двумя молекулами должно быть их соударение. Однако не все соударения эффективны. Реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым образовать новые связи. Поэтому каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации. Этот барьер можно представить графически (рис. 49), который показывает относительные энергии реагирующих веществ и продуктов реакции.
 |
Рис. 48. Зависимость ln K от 1/T
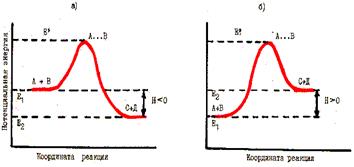
Рис. 49. Энергетические диаграммы
для экзо - реакции (а) и для эндо - реакции (б)
Все молекулы в системе, запас энергии, которых не ниже энергетического барьера реакции, находятся в особом состоянии, которое принято называть переходным или состоянием активированного комплекса. Можно предположить, что система в состоянии активированного комплекса характеризуется тем, что в ней уже нет исходных веществ, но нет еще и продуктов реакции. Схематический переход от исходных веществ А и В к продукции реакции С и Д через состояние активированного комплекса А … В представлен на рис. 49.
В качестве примера на рис. 50 представлена диаграмма, которая иллюстрирует реакцию между окисью углерода СО и двуокисью азота NO2 с образованием двуокиси углерода СО2 и окиси азота NO. Из рисунка видно, что энергия активация  - это энергия, необходимая для превращения реагирующих веществ в состояние активированного комплекса.
- это энергия, необходимая для превращения реагирующих веществ в состояние активированного комплекса.
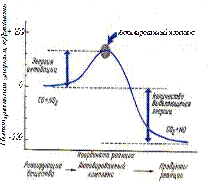
Рис. 50. Диаграмма потенциальной энергии
для реакции CO + NO2 → CO2 + NO
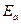 - зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
- зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
Обычно реакции между веществами с прочными связями характеризуются большими значениями 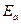 и идут медленно, например
и идут медленно, например
N2O4→2NO2 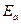 = 54,4 кдж/моль
= 54,4 кдж/моль
H2 + I2 →2HI 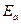 = 165,5 кдж/моль
= 165,5 кдж/моль
Реакции, для которых 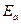 > 150 кдж/моль при комнатной температуре не протекают.
> 150 кдж/моль при комнатной температуре не протекают.
Малыми значениями 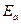 и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов, например:
и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов, например:
Ba2+ + SO 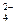 → BaSO4
→ BaSO4
Это связано с тем, что разноименно заряженные ионы притягиваются друг к другу и не требуется затрачивать энергию на преодоление сил отталкивания взаимодействующих частиц.
Множитель А в уравнении Аррениуса должен отвечать общему числу соударений молекул Z реагирующих веществ в единицу объема за единицу времени. Для химического взаимодействия молекулам необходим не только избыток энергии, равный 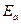 , но еще и определенная их взаимная ориентация. Влияние пространственной ориентации молекул на скорость реакции может быть учтена с помощью так называемого стерического фактора Р:
, но еще и определенная их взаимная ориентация. Влияние пространственной ориентации молекул на скорость реакции может быть учтена с помощью так называемого стерического фактора Р:
A = P ∙ Z
Значение Р обычно лежат в пределах от 10-9 до 1. При этом малые величины Р отвечают чаще всего реакциям между сложными по своей структуре органическими соединениями.
Скорость гетерогенных химических реакций. Реакция в гетерогенной системе осуществляется на поверхности раздела фаз. Средняя скорость гетерогенной химической реакции равна
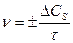
где СS - поверхностная концентрация, измеряется количеством молей веществ, приходящихся на единицу реакционной поверхности (моль/м2 или моль/см2).
Зависимость скорости гетерогенной химической реакции от поверхностной концентрации реагентов, так же как и зависимость скорости галогенной реакции от объемной концентрации, определяется законом действия масс.
Например, зависимость скорости процесса
CaO (k) + CO2 (г) → CaCO3 (k)
при Т = const от поверхностной концентрации CO2 имеет вид:
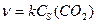 ,
,
где 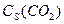 - поверхностная концентрация CO2, моль/м2
- поверхностная концентрация CO2, моль/м2
В некоторых случаях вычисляют скорость гетерогенного процесса, используя вместо поверхностной концентрации объемную концентрацию.
Например:
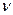 = k ∙ C (CO2)
= k ∙ C (CO2)
где 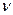 - скорость реакции, моль/л с;
- скорость реакции, моль/л с;
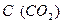 - объемная концентрация СО2.
- объемная концентрация СО2.
Колебательные реакции. Колебательные или периодические реакции характеризуются колебаниями концентрации некоторых промежуточных соединений и соответственно скоростей превращения. Наблюдаются в газовой и жидкой фазах (особенно часто на границе раздела этих фаз с твердой фазой). Колебательными чаще всего бывают окислительно-восстановительные реакции, а также реакции, сопровождающиеся появлением новой фазы вещества. Причина возникновения колебаний концентрации - наличие обратных связей между отдельными стадиями сложной реакции: положительных, когда продукт реакции ускоряет ее (например, в разветвленных цепных стадиях, при автокатализе, саморазогреве), и отрицательных, когда в ходе реакции вырабатывается ингибитор ее начальных стадий.
Колебания часто возникают при работе промышленных проточных реакторов (например, при полимеризации этилена, окисление СО). Обычно они вредны, снижают однородность продукта, приводят к аварийным ситуациям. Однако в некоторых случаях проведение реакции в колебательном режиме может увеличить выход продукта. Колебательные реакции лежат в основе ряда важнейших биологических процессов; генерации нервных импульсов, мышечного сокращения, генерации биоритмов.
Дата добавления: 2016-12-09; просмотров: 2053;











