Влияние концентрации компонентов на направление химической реакции и равновесие в системе
Пусть в закрытой газовой системе при p, T = const протекает химическая реакция:
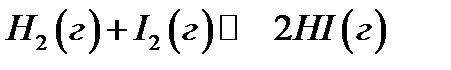
при вступлении H2 и I2 в реакцию скорость прямой реакции:
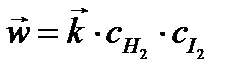
где 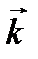 ‑ константа скорости прямой реакции;
‑ константа скорости прямой реакции; 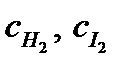 ‑ весовые концентрации.
‑ весовые концентрации.
После образования HI скорость обратной реакции:
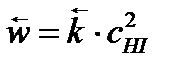
где 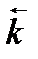 ‑ константа скорости обратной реакции.
‑ константа скорости обратной реакции.
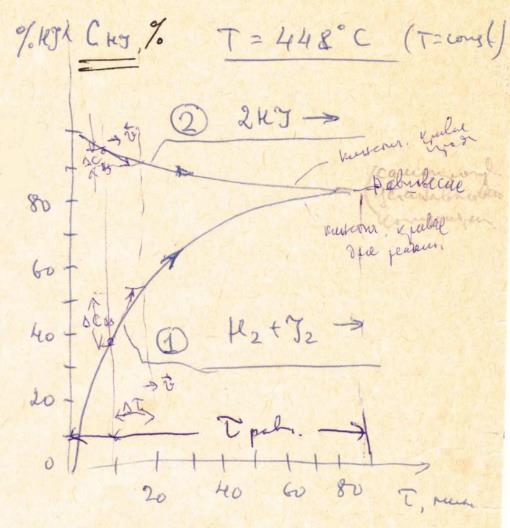
При равенстве скоростей встречных реакций наступает равновесие:
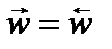
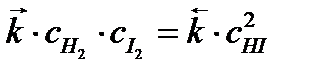
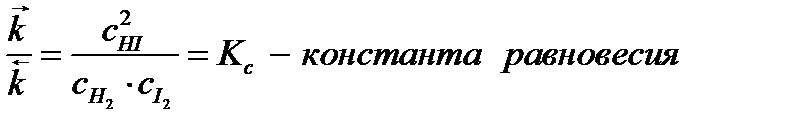
В общем случае:
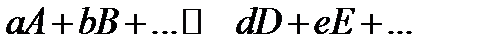
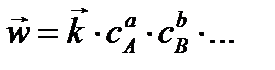
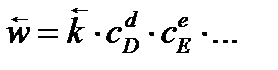
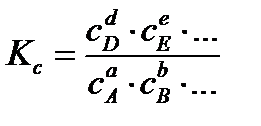
Главная особенность протекания обратимых химических реакций заключается в стремлении достичь динамического равновесия, так как это состояние возникает и поддерживается вследствие протекания реакций в двух противоположных направлениях с одинаковыми скоростями 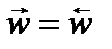 . Такое состояние называется химическим равновесием.
. Такое состояние называется химическим равновесием.
Вспомним, как изменяется энергия Гиббса системы, в которой устанавливается химическое равновесие. В этом случае изменение энергии Гиббса в системе характеризуется наличием минимума, который соответствует состоянию химического равновесия. К этому равновесному состоянию возможен подход как со стороны исходных веществ 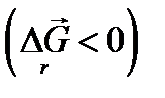 , так и со стороны продуктов реакции
, так и со стороны продуктов реакции 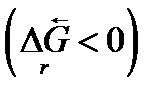 .
.
Таким образом, в случае протекания обратимых реакций система самопроизвольно приходит к состоянию химического равновесия, из которого она без внешнего воздействия не может выйти, поскольку это требует увеличения энергии Гиббса.
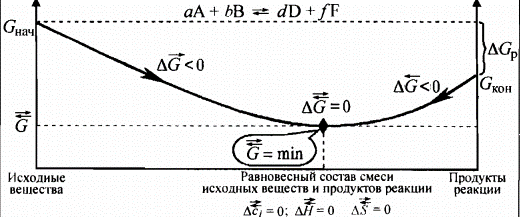
Химическое равновесное состояние системы характеризуется:
1. равенством скоростей прямой и обратной реакций ( 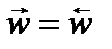 );
);
2. энергетической выгодностью ( 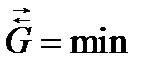 );
);
3. отсутствием изменений величин параметров и функций состояния системы: концентрации реагентов ( 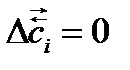 ), энтальпии (
), энтальпии ( 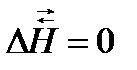 ), энтропии (
), энтропии ( 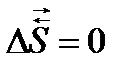 ) и энергии Гиббса (
) и энергии Гиббса ( 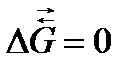 ).
).
Поскольку в состоянии химического равновесия система достигает минимально возможного значения энергии Гиббса, то реакция, которая приводит в данных условиях к состоянию равновесия, всегда протекает самопроизвольно.
Дата добавления: 2021-02-19; просмотров: 658;











