Семинар. Расчет равновесий в многокомпонентной гомогенной среде. Константа равновесия
Общим условием равновесия в любой системе (гомогенной или гетерогенной) при условии T = const и p = const является постоянство термодинамического потенциала G, который представляет собой сумму термодинамических потенциалов всех веществ, входящих в нее в соответствующих числах молей. Таким образом, изменения термодинамического потенциала в системе при равновесии не происходит:
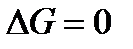
Рассмотрим условия равновесия системы, в которой может протекать химическая реакция между газообразными веществами, на примере образования углекислого газа, обратимо распадающегося на окись углерода и кислород в условиях высоких температур:

Суммируем термодинамические потенциалы продуктов реакции, причем для начальных (исчезающих) веществ принимаем знак минус, а для конечных (образующихся) – знак плюс. Тогда получим:
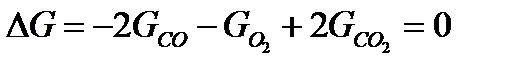
Значение термодинамического потенциала каждого из веществ согласно уравнению можно записать следующим образом:
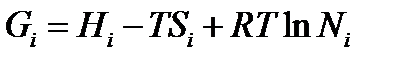
так как необходимо учесть влияние концентраций, изменяющее, в свою очередь, величину энтропии.
Подставляя развернутые значения термодинамических потенциалов всех веществ в выражение суммы, получим:
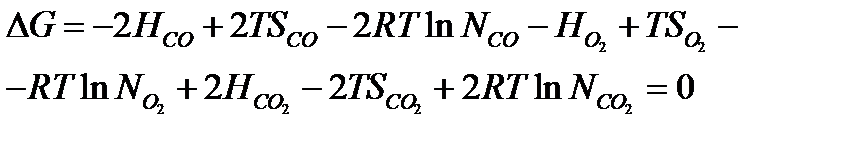
Группируем члены выражения следующим образом:
1) 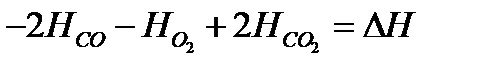 или разность энтальпий реакции;
или разность энтальпий реакции;
2) 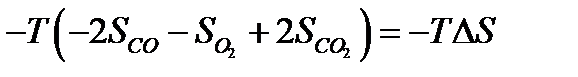 , где ΔS – разность энтропий конечных и начальных веществ реакции;
, где ΔS – разность энтропий конечных и начальных веществ реакции;
3) 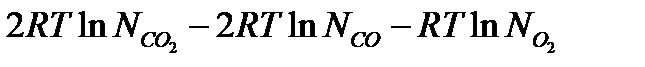 можно представить как логарифм отношения молярных долей в степенях, равных коэффициентам реакции, или:
можно представить как логарифм отношения молярных долей в степенях, равных коэффициентам реакции, или:
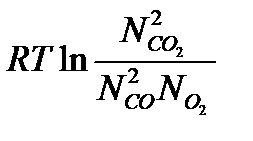
Запишем уравнение суммы термодинамических потенциалов в преобразованном виде:
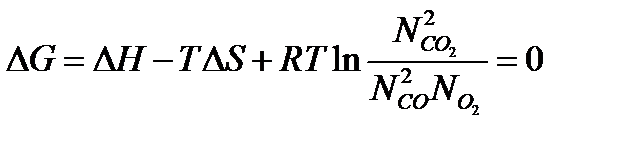
Выражение под знаком логарифма принято называть константой равновесия, так как оно определяет соотношение концентраций реагирующих веществ в момент равновесия:
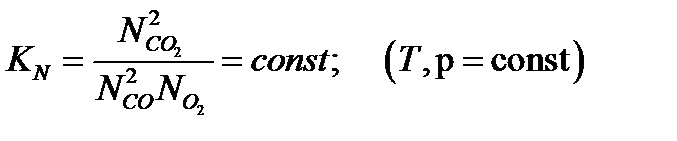
Константа равновесия обратимых химических реакций, которая в курсе общей химии обычно выводится из условия равенства скоростей прямой и обратной реакции, является очень важной термодинамической функцией, зависящей от температуры и энергоизменения в процессе реакции – ΔH.
В самом деле, подставляя KN вместо его выражения, получим
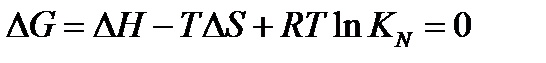
или
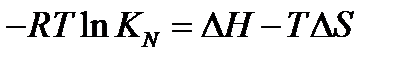
Отсюда получаем зависимость константы равновесия от температуры:
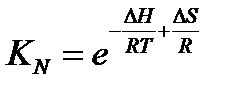
Соотношения равновесных концентраций в газообразных системах удобнее выражать через парциальные давления компонентов (Kp), но в этом случае значение константы равновесия будет другим и, кроме того, оно будет иметь размерность давления в той или другой степени.
Найдем зависимость между константами равновесия Kp и KN в общем случае. Рассмотрим реакцию между газообразными веществами A, B, C, D, вступающими в реакцию с коэффициентами a, b, c, d:
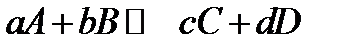
Константа равновесия, выраженная через молярные доли:
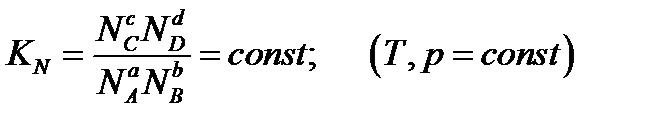
Константа равновесия, выраженная через парциальные давления:
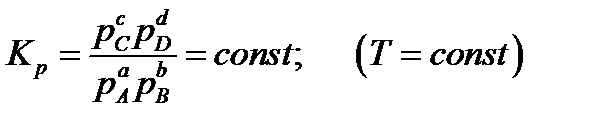
Так как парциальное давление равно общему давлению в системе p0, умноженному на молярную дробь Ni, то можно подставить в уравнение Kp значения парциальных давлений:
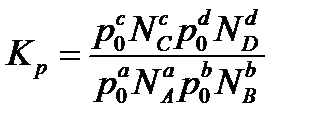
Группируя члены выражения Kp, можно представить его в следующем виде:
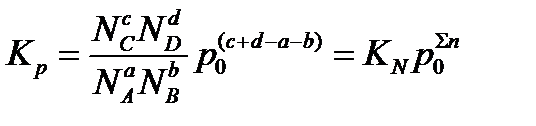
где 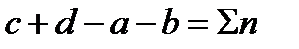 ‑ сумма коэффициентов уравнения реакции, в которую коэффициенты начальных продуктов входят со знаком минус, в конечных продуктов со знаком плюс.
‑ сумма коэффициентов уравнения реакции, в которую коэффициенты начальных продуктов входят со знаком минус, в конечных продуктов со знаком плюс.
Константы равновесия Kp и KN по своей величине совпадают в двух случаях:
1) Если число молей начальных веществ равно числу газообразных молей конечных веществ. Например:
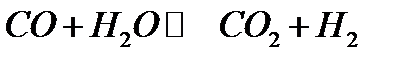
В этом случае 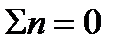 и Kp = KN.
и Kp = KN.
2) Если общее давление в системе p = 1Н/м2 ( или 1 атм), то в этом случае Kp и KN будут численно равны, но Kp будет сохранять размерность давления в степени 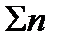 .
.
Константу равновесия можно выражать и в других величинах, определяющих соотношения концентраций веществ в момент равновесия, например в объемных концентрациях моль/л (Kc) и т.д.
Для понимания законов, определяющих протекание химических реакций, необходимо рассматривать их с позиций как термодинамики, так и химической кинетики.
Раздел химии, изучающий механизмы химических реакций и скорости их протекания, называется химической кинетикой.
Если термодинамика позволяет узнать, насколько полно осуществится превращение исходных реагентов в продукты реакции, то химическая кинетика отвечает на вопросы:
– как быстро совершается химическая реакция;
– каков механизм реакции, т.е. каков ее путь.
Дата добавления: 2021-02-19; просмотров: 583;











