Свободная энергия (потенциал) Гельмгольца
F = U – TS; после дифференцирования получим:
dF = dU – TdS – SdT; вспоминая, что TdS= dU+ dA +ε,
получим: dF=dA–SdT=–SdT–pdV–ε.(24)
Если T, V = const и ε → 0,
 Стремление функции «свободная энергия Гельмгольца» к минимальному значению указывает на приближение системы к равновесию. Условие равновесия: ΔF = 0 (25)
Стремление функции «свободная энергия Гельмгольца» к минимальному значению указывает на приближение системы к равновесию. Условие равновесия: ΔF = 0 (25)
Свободная энергия (потенциал) Гиббса
G = U–TS + pV = H–TS;
dG = dU – TdS – SdT + pdV + Vdp. Выполнив аналогичное преобразование,
получим: dG = –SdT + Vdр– ε. приT, р= const и ε → 0(26)
 Стремление функции «свободная энергия Гельмгольца» к
Стремление функции «свободная энергия Гельмгольца» к
минимальному значению указывает на приближение системы к равновесию. Условие равновесия: ΔG = 0 (27)
Произведение TS характеризует связанную с частицами свободную энергию, т.е. ту часть полной энергии системы, которая рассеивается в окружающую среду в виде теплоты; это – «потерянная работа».
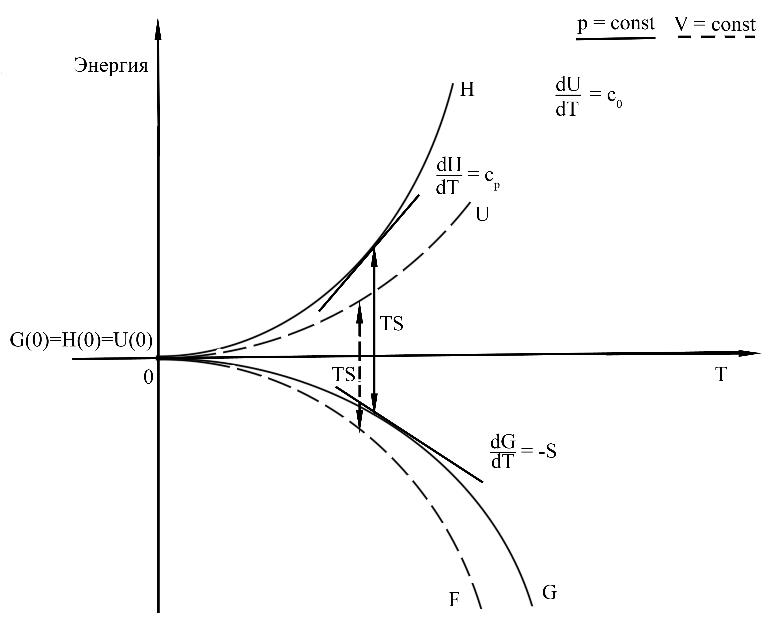
Диаграмма Кирдеева
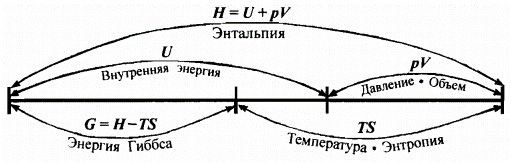
Следовательно, энергия Гиббса и энергия Гельмгольца характеризуют ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермическом или изохорно-изотермическом процессах соответственно (так называемая полезная работа, совершаемая системой). В этом состоит физический смысл величин G и F. Энергия Гиббса и энергия Гельмгольца – функции состояния системы, их абсолютные значения не поддаются вычислению. Для одного моля чистого вещества потенциал Гиббса равен химическому потенциалу вещества:
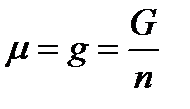 (28)
(28)
Подобно другим термодинамическим параметрам и функциям, характеризующим состояние системы, изменение энергии Гиббса в результате любого процессаопределяется только начальным и конечным состоянием системы, независимо от пути процесса.
DG =Gкон-Gнач (29)
Для полной энергетической характеристики вещества при стандартных условиях используют стандартную энергию Гиббса образования вещества ΔG˚, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
Термодинамический критерий равновесия
Если G=Gmin , (энергия Гиббса имеет минимальное значение) и DG = 0система находится в состоянии термодинамического равновесия.
Применение этой функции к решению практически важных вопросов расчета равновесия, как предельно достижимого состояния реагирующих систем, требует некоторого дополнительного исследования термодинамического потенциала и его вычисления.
Для обратимых процессов или условия равновесия можно определить значения частных производных термодинамического потенциала:
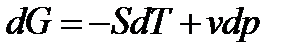
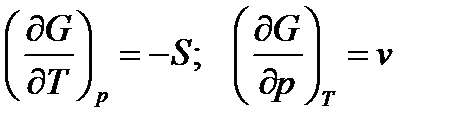 или
или
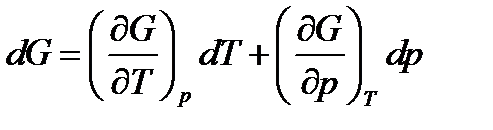 . (30)
. (30)
Таким образом, термодинамический потенциал может быть рассчитан для 1 моля вещества, так же как и энтропия, так как частная производная от термодинамического потенциала по давлению, при условии постоянной температуры, равна молярному объему.
Термодинамический потенциал системы, состоящей из ряда компонентов, будет суммироваться по всем компонентам с учетом их взаимного влияния (концентрация или активность). Поэтому полный дифференциал термодинамического потенциала системы можно записать следующим образом:
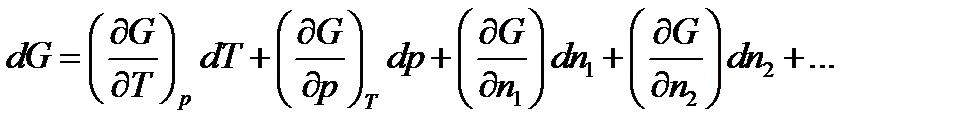 (31)
(31)
где n1, n2 и т.д. – числа молей компонентов системы.
В общем случае при наличии в системе необратимых процессов на основании уравнения (26) этот же полный дифференциал равен:
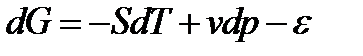
Сопоставляя уравнения между, можно установить условия равновесия в системе при T = constи p = const:
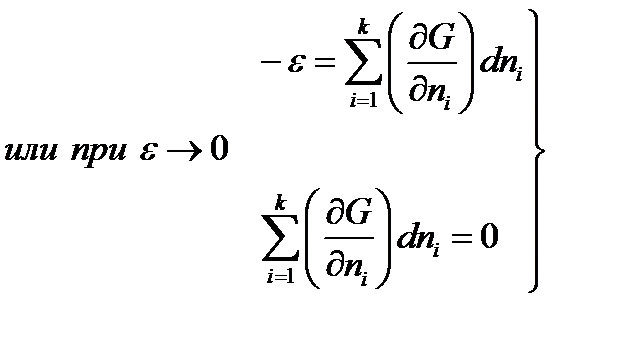 (32)
(32)
Таким образом, при условии p, T = const необратимость системы зависит от изменения числа молей компонентов в химически реагирующей системе, а в момент равновесия изменения числа молей непроисходит.
Изменение энергии Гиббса в результате химической реакции при стандартных условиях вычисляют по уравнению:
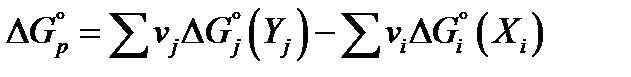 (33)
(33)
где 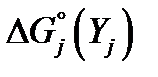 ,
, 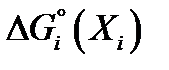 – стандартные энергии Гиббса продуктов реакции Yj и исходных веществ Xi; vj и vi– соответствующие стехиометрические коэффициенты в уравнении химической реакции.
– стандартные энергии Гиббса продуктов реакции Yj и исходных веществ Xi; vj и vi– соответствующие стехиометрические коэффициенты в уравнении химической реакции.
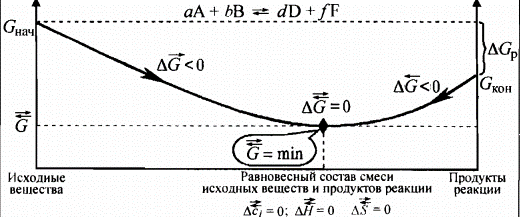
Проводя аналогию с диаграммой Кирдеева при T, р = const, получим
DGр= Gкон -Gнач = DH-TDS (34)
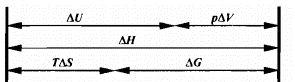
В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях:
- при DGр = 0 (G=Gmin ,энергия Гиббса имеет минимальное значение) система находится в состоянии термодинамического равновесия;
- приDGр< 0 (G>Gкон , энергия Гиббса убывает) процесс самопроизвольно протекает в прямом направлении, т.е. термодинамически возможен; критерий ничего не говорит о скорости процесса и необходимых условиях для его начала;
- при Gр> 0 (G<Gкон), энергия Гиббса возрастает) самопроизвольно протекает только обратный процесс, прямой процесс термодинамически невозможен
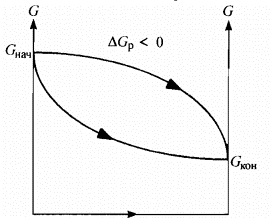 возможна прямая реакция, идущая до конца
возможна прямая реакция, идущая до конца
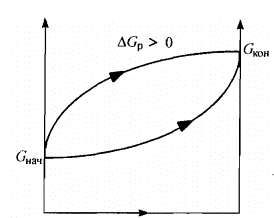 прямая реакция невозможна
прямая реакция невозможна
В системе при р = const, T = соnst самопроизвольно могут совершаться только такие процессы, в результате которых G уменьшается, DG < 0(Еще одна формулировка 2-го закона термодинамики).
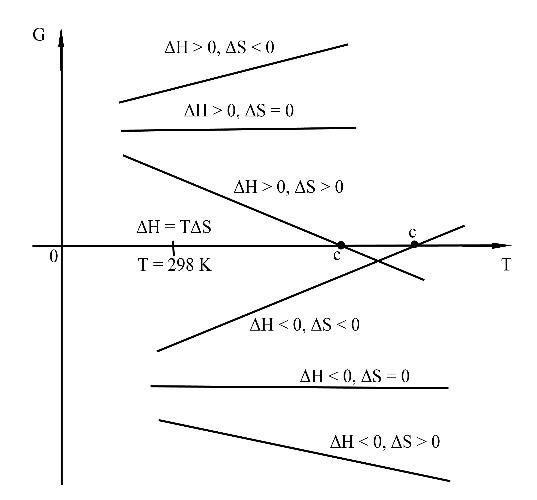
Ситуация изменится, если Т = var.
Cистема находится в равновесии (ΔG = 0) при любой температуре, если ΔН= TΔS. Запрещенные процессы – выше оси температур, разрешенные располагаются ниже оси.
| DG |
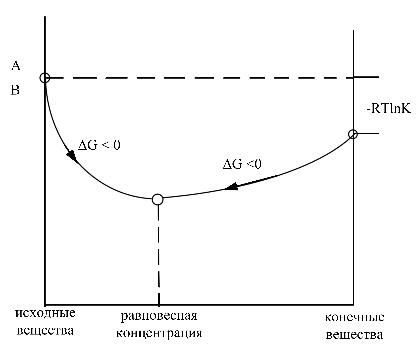
.
…………………………………………………………..
Продолжение следует!!!!!
В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях:
- при DG = 0 (G = Gmin ,энергия Гиббса имеет минимальное значение) система находится в состоянии термодинамического равновесия;
- при DG < 0 (G < Gmin , энергия Гиббса убывает) процесс самопроизвольно протекает в прямом направлении, т.е. термодинамически возможен; критерий ничего не говорит о скорости процесса и необходимых условиях для его начала;
- при G > 0 (G > Gmin, энергия Гиббса возрастает) самопроизвольно протекает только обратный процесс, прямой процесс термодинамически невозможен.
Чем больше значение энергии Гиббса в начальном состоянии по сравнению с конечным, тем больше химическое сродство между реагентами в рассматриваемой системе. Если при заданных условиях реакция не идет до конца, равновесный состав системы определяется константой равновесия.
Композиционные материалы – это многокомпонентные гетерогенные термодинамические системы с развитой сетью границ, в которых микроскопические параметры, порождающие поверхностные явления, начинают значительно влиять на энергетику макропроцессов.
Дата добавления: 2021-02-19; просмотров: 1079;











