Тема. Основы кинетики химических реакций и химического равновесия
Основные понятия и терминология
Гомогенные реакции характеризуются отсутствием поверхности раздела между реагентами, а реакция протекает по всему объему системы.
а) 2 BCl3 (г) + 3 H2 (г) → 2 Втв + 6HCl(г)
При гетерогенных реакциях реагирующие вещества, как правило, находятся в разных агрегатных состояниях, а реакция протекает на поверхностях раздела реагирующих веществ.
б) 3 SiC тв + 4Al ж → Al4C3 тв + 3Si раств
Одним из основных параметров химических реакций является скорость, с которой они протекают.
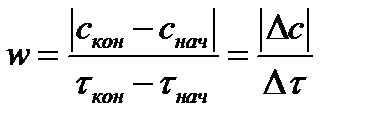
Если измерять концентрации веществ в молях на литр, а время – в секундах, то единицей измерения скорости реакции будет моль/(л·с).
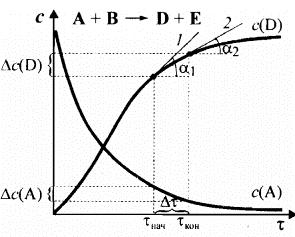
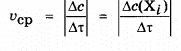
Рисунок. Кинетические кривые по реагенту (А) и продукту (D) приведенной реакции
Так как в реакции могут принимать участие в качестве реагентов и продуктов несколько веществ (соединений), следует говорить не о скорости химического процесса вообще, а о скорости реакции по какому-либо одному компоненту (Xi). Кинетическая кривая, отражающая изменение концентрации какого-либо вещества во времени c(Xi)=f(τ) в ходе химической реакции, имеет разный вид для реагента и продукта реакции. Кинетическая кривая дает информацию об истинной (мгновенной) скорости реакции в каждый момент времени. Истинная скорость реакции в данных момент времени (τнач , τкон) определяется на графике как тангес угла наклона соответствующей качательной (1, 2) к оси времени.
Истинная скорость химической реакции характеризует скорость в данный момент времени (Δτ → 0):
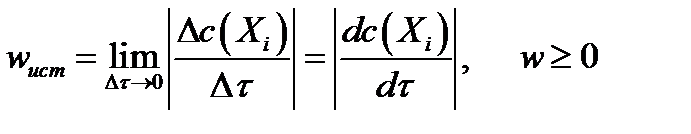
Как видно из рисунка, касательные 1 и 2 характериются разными углами наклона α1 и α2, что свидетельствует об изменении скорости химической реакции по мере ее протекания. Поэтому наряду с истинной скоростью для характеристики химического процесса используют также среднюю скорость.
Средняя скорость химической реакции по данному компоненту является усредненной скоростью за данный промежуток времени
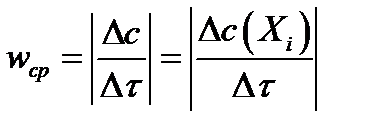
Средняя скорость химической реакции – величина приближенная. Истинная скорость является более объективной характеристикой реакции, но и она неудобна для сравнения скоростей различных реакций между собой вследствие ее изменяемости во времени. Поэтому ни истинная, ни средняя скорости реакции не используются в качестве ее кинетических характеристик; такой величиной является константа скорости реакции.
Каждая химическая реакция протекает по определенному механизму. Механизм реакции описывает ее путь, т.е. последовательность элементарных актов взаимодействия реагентов, через которые она протекает. Реакции, по их механизму, подразделяются на простые и сложные.
Простые, или элементарные, реакции – это реакции, протекающие в одну стадию.
Для таких реакций химическое уравнение полностью отражает, какие частицы и в каких соотношениях непосредственно участвуют в элементарном акте реакции. Например:
а) 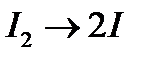
б) 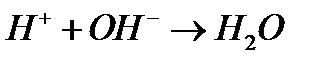
в) 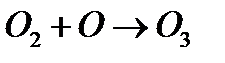
Большинство химических и все биохимические реакции являются сложными.
Сложные реакции – это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Например, реакция 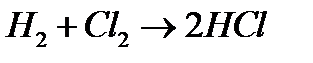 является сложной. Обнаружено, что она протекает через множество стадий.
является сложной. Обнаружено, что она протекает через множество стадий.
Для сложных реакций общее химическое уравнение отражает только количественную характеристику процесса в целом и не учитывает, какие частицы и в каких соотношениях участвуют в отдельных стадиях процесса. Стадии сложных реакций могут протекать:
– последовательно друг за другом
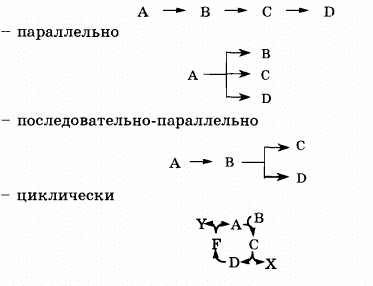
В сложных реакциях скорости отдельных стадий могут резко отличаться друг от друга. В этих случаях скорость сложной реакции в целом будет определяться скоростью наиболее медленной стадии, называемой скорость определяющей или лимитирующей стадией. Поэтому при изучении механизма реакции по кинетическим данным прежде всего определяют кинетические характеристики ее лимитирующей стадии.
Дата добавления: 2021-02-19; просмотров: 863;











